题目内容
19.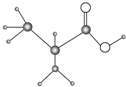 如图是只含有C、H、O、N四种元素的有机物的简易球棍模型,完成下列问题:
如图是只含有C、H、O、N四种元素的有机物的简易球棍模型,完成下列问题:(1)该物质的结构简式为
 .
.(2)已知-NH2与NH3类似,能与盐酸反应,请写出该物质与盐酸反应的化学方程式:CH3CH(NH2)COOH+HCl→CH3CH(COOH)NH3Cl.
(3)该物质能否与NaOH溶液反应能(填“能”或“不能”).该有机物一定条件下可以反应生成更复杂的化合物(多肽),请写出2分子该物质相互反应成二肽的方程式CH3CH(NH2)COOH+NaOH→CH3CH(NH2)COONa+H2O.
分析 (1)根据原子成键方式知,该有机物结构简式为HO-CH2-CH2-NH-CO-CH2-CH3;
(2)CH3CH(NH2)COOH与HCl反应生成CH3CH(COOH)NH3Cl;
(3)CH3CH(NH2)COOH和NaOH反应生成CH3CH(NH2)COONa和H2O.
解答 解:(1)根据原子成键方式知,能形成4个共价键的原子是C原子、能形成1个共价键的原子是H原子、能形成3个共价键的是N原子、能形成2个共价键的是O原子,所以该有机物结构简式为 ,故答案为:
,故答案为: ;
;
(2)CH3CH(NH2)COOH与HCl反应生成CH3CH(COOH)NH3Cl,化学方程式为CH3CH(NH2)COOH+HCl→CH3CH(COOH)NH3Cl,故答案为:CH3CH(NH2)COOH+HCl→CH3CH(COOH)NH3Cl;
(3)CH3CH(NH2)COOH和NaOH反应生成CH3CH(NH2)COONa和H2O,化学方程式为CH3CH(NH2)COOH+NaOH→CH3CH(NH2)COONa+H2O,故答案为:能;CH3CH(NH2)COOH+NaOH→CH3CH(NH2)COONa+H2O.
点评 本题考查有机物结构和性质,题目难度不大,本题注意把握常见有机物的官能团的性质,记住反应条件,常见有机物反应的化学方程式要会写.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.将a g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为( )
| A. | a g | B. | $\frac{3a}{4}$ g | C. | $\frac{3a}{2}$ g | D. | $\frac{4a}{3}$g |
16.等体积的盐酸和醋酸分别和等量的锌反应,已知反应开始时速率相等,反应结束后两种酸均有剩余,下列判断中不正确的是( )
| A. | 反应前两种酸的物质的量浓度不同 | |
| B. | 反应开始后,盐酸的H+浓度减小快 | |
| C. | 反应开始后,醋酸的H+浓度减小快 | |
| D. | 从反应开始到结束,两种酸所用的时间相同 |
7.a g铁粉和铝粉的混合物,溶于足量盐酸后,加过量的NaOH溶液,过滤,将沉淀完全收集后,充分加热,直至质量不再变化,称量仍为a g.原混合物中铝粉的质量分数是( )
| A. | 30% | B. | 50% | C. | 70% | D. | 90% |
4.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 0.1 mol•L-1的氨水含有0.1NA个OH- | |
| B. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA | |
| D. | 在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数为NA |
11.下列物质不属于高分子材料的是( )
| A. | 淀粉 | B. | 油脂 | C. | 天然橡胶 | D. | 羊毛 |
8.在酸性无色溶液中,下列各组离子一定能大量共存的是( )
| A. | MnO4-、H+、K+、NO3- | B. | Na+、H+、Cl-、NO3- | ||
| C. | Ba2+、H+、SO42-、Cl- | D. | H+、Fe3+、SO42-、Cl- |
9.下列有关钠的说法中,不正确的是( )
| A. | 工业上通过电解氯化钠溶液制取金属钠 | |
| B. | 高压钠灯常用于道路和广场的照明 | |
| C. | 钠钾合金可在快中子反应堆中作热交换剂 | |
| D. | 钠可用于从钛、铌等金属的氯化物中置换出金属单质 |