题目内容
1.下列说法正确的是( )| A. | 金属元素不能得电子,不显负价,故金属元素不能形成阴离子 | |
| B. | P,S,Cl元素最高价依次升高 | |
| C. | B,C,N,O,F原子半径依次增大 | |
| D. | Li,Na,K,Rb的氧化物对应水化物的碱性依次减弱 |
分析 A.金属元素可以阴离子,如AlO2-;
B.同周期自左而右主族元素最高正化合价增大;
C.同周期自左而右原子半径减小;
D.金属性越强,最高价氧化物对应水化物的碱性增强.
解答 解:A.金属元素不能形成简单离子,但可以形成带负电荷的电原子团,如AlO2-,故A错误;
B.P、S、Cl元素最外层电子数依次增大,故最高价依次升高,故B正确;
C.同周期自左而右,核电荷数增大,原子核对核外电子吸引增大,原子半径减小,故C错误;
D.同主族自上而下金属性增强,金属性越强,最高价氧化物对应水化物的碱性增强,故Li、Na、K、Rb的氧化物对应水化物的碱性依次增强,故D错误,
故选B.
点评 本题考查元素周期律,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列有关油脂的叙述中,不正确的是( )
| A. | 油脂没有固体的熔点,因为油脂是混合物 | |
| B. | 油脂是由高级脂肪酸和甘油所生成的酯 | |
| C. | 油脂可以在酸性或碱性条件下水解 | |
| D. | 油脂都不能使溴水褪色 |
12.下列判断正确的是( )
| A. | 电负性:O>F | B. | 第一电离能:K>Na | ||
| C. | 未成对电子数:N>C | D. | o-键数:C2H2>CH4 |
6.在下列酸中,同时投入大小相同且打磨至表面光亮的铝片,产生氢气的速率最快的是( )
| A. | 10mL 0.4mol/L硝酸 | B. | 10mL 0.2mol/L硫酸 | ||
| C. | 10mL 0.2mol/L盐酸 | D. | 50mL 0.1mol/L盐酸 |
13.下列说法正确的( )
| A. | 燃料的燃烧反应、酸碱中和反应均是放热反应 | |
| B. | 化学反应释放或吸收能量的多少与反应物或产物的量无关 | |
| C. | 反应物的总能量小于生成物的总能量的反应是放热反应 | |
| D. | 放热反应一定不需要加热就能发生 |
11.25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是△H=-393.5kJ/mol、△H=-285.8kJ/mol、△H=-890.3kJ/mol、△H=-2800kJ/mol,则下列热化学方程式正确的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-393.5kJ/mol | |
| B. | 2H2(g)+O2(g)═2H2O(g);△H=+571.6kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-890.3kJ/mol | |
| D. | $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l);△H=-1400kJ/mol |
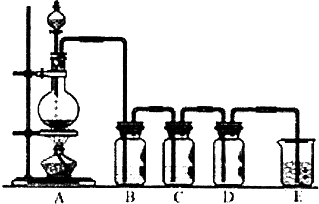 (1)若利用如图装置制备纯净、干燥的氯气,装置A中反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.则装置B中的液体是饱和NaCl溶液;装置C中试剂的作用是干燥氯气
(1)若利用如图装置制备纯净、干燥的氯气,装置A中反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.则装置B中的液体是饱和NaCl溶液;装置C中试剂的作用是干燥氯气