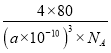题目内容
【题目】已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大。X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态。请回答下列问题:
(1)R基态原子的外围电子排布式为____,其基态原子有__种能量不同的电子。
(2)元素X、Y、Z的第一电离能由小到大的顺序为(用元素符号表示)____。
(3)与XYZ-互为等电子体微粒的化学式为______(写出一种即可),XYZ-的中心原子的杂化方式为_____。
(4)R2+与NH3形成的配离子中,提供孤对电子的原子是__。
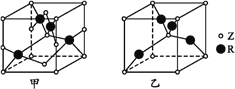
(5)已知Z、R能形成两种化合物,其晶胞如图所示,甲的化学式为__,乙的化学式为__;高温时,甲易转化为乙的原因为_____________。
(6)若甲晶体中一个晶胞的边长为a pm,则甲晶体的密度为______g·cm-3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。
【答案】 3d104s1 7 N>O>C CO2或N2O或SCN- sp N CuO Cu2O Cu2O中的Cu的3d能级是全充满状态,而原子处于全充满、半充满、全空是稳定结构 ![]()
【解析】核外电子有6种不同的运动状态,则核外有6个电子,即X是碳(C);Z原子的L电子层上有2对成对电子,是2p4,则为氧(O);根据原子序数递增知Y是氮(N);R+原子核外有3层电子且各层均处于全满状态,分别有2、8、18个电子,即R是铜(Cu)。
(1)Cu的基态原子的外围电子排布式为3d104s1,核外电子分布在1s、2s、2p、3s、3p、3d、4s,共7个能级,因此其基态原子有7种能量不同的电子,
故答案为:3d104s1;7;
(2)同周期第一电离能由左向右呈增大的趋势,ⅡA元素原子的s能级是全充满状态、ⅤA元素原子的p能级是半充满状态,它们第一电离能比相邻元素大,即第一电离能:N>O>C,
故答案为:N>O>C;
(3)与CNO互为等电子体微粒的化学式有CO2、N2O、SCN等,互为等电子体的物质结构相似,CO2的结构是直线型,C原子采取sp杂化,因此CNO的中心原子的杂化方式为sp,
故答案为:CO2或N2O或SCN;sp;
(4)N原子有孤对电子,Cu2+有空轨道,即N提供孤对电子;
故答案为:N;
(5)根据均摊法知甲晶胞中含Cu原子4个,O原子:8×![]() +4×
+4×![]() +2×
+2×![]() +1=4,化学式为CuO;乙含Cu原子4个,O原子:8×
+1=4,化学式为CuO;乙含Cu原子4个,O原子:8×![]() +1=2,化学式为Cu2O,CuO易转变为Cu2O,是因为Cu2O中的Cu的3d能级是全充满状态,而原子处于全充满、半充满、全空是稳定结构。
+1=2,化学式为Cu2O,CuO易转变为Cu2O,是因为Cu2O中的Cu的3d能级是全充满状态,而原子处于全充满、半充满、全空是稳定结构。
故答案为:CuO;Cu2O;Cu2O中的Cu的3d能级是全充满状态,而原子处于全充满、半充满、全空是稳定结构。
(6)甲中1个晶胞含4个Cu原子,4个O原子,m=![]() ,晶胞体积为(a×1010)3m3,则密度=
,晶胞体积为(a×1010)3m3,则密度= 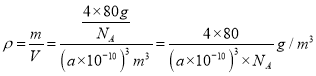 。
。
故答案为: