题目内容
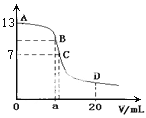
【题目】常温下,含碳微粒(H2C2O4、HC2O4-、C2O42-)存在于0.1mol/L草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数ω(某微粒物质的量浓度与三种微粒物质的量浓度和比值)与溶液pH的关系如图所示,下列有关说法错误的是
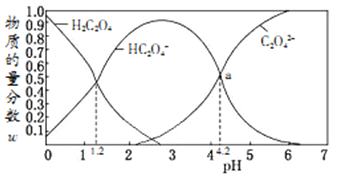
A. 向pH=1.2的溶液中加NaOH溶液将pH增大至4.2的过程中水的电离度一直增大
B. pH=4.2时,溶液中c(Na+)>c(HC2O4-)+c(C2O42-)
C. 若草酸的第二级电离平衡常数为K2,则lgK2=-4.2
D. 将0.1mol/L相同物质的量浓度NaHC2O4和Na2C2O4的两份溶液等体积混合,可配得上图a点所示混合液
【答案】D
【解析】pH=1.2的溶液中加NaOH溶液将pH增大至4.2,草酸逐渐减少,草酸钠增多,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,故A正确;pH=4.2时,c(HC2O4-)=c(C2O42-),根据电荷守恒c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+ c(OH-),c(H+)和c(OH-)忽略,所以c(Na+)>c(HC2O4-)+c(C2O42-),故B正确;pH=4.2时,c(HC2O4-)=c(C2O42-),Ka2=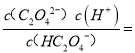 c(H+)=10-4.2,则lgK2=lg10-4.2=-4.2,故C正确;HC2O4的电离常数是10-4.2,C2O42-的水解常数是
c(H+)=10-4.2,则lgK2=lg10-4.2=-4.2,故C正确;HC2O4的电离常数是10-4.2,C2O42-的水解常数是![]() ,HC2O4的电离大于C2O42-的水解,所以c(HC2O4-)≠c(C2O42-),故D错误。
,HC2O4的电离大于C2O42-的水解,所以c(HC2O4-)≠c(C2O42-),故D错误。

练习册系列答案
相关题目