题目内容
【题目】“碳化学”是绿色化学的重要组成部分。
(1)由CO2制备甲醇的过程发生的主要反应如下:
反应I: CO2(g)+ 3H2(g) ![]() CH3OH(g)+ H2O(g) △H 1<0;
CH3OH(g)+ H2O(g) △H 1<0;
向2 L恒容密闭容器中充入3molH2和1.5molCO2,在一定条件下该反应l0min时达到平衡状态,二氧化碳的转化率a(CO2)=60%,则v(H2) =_________________________。(填字母)。
若要同时提高反应速率和甲醇的产量,以下措施一定可行的是
a.升高温度 b.缩小容器体积 c.分离出甲醇 d.增加CO2的浓度
(2)已知: CO2(g)+ 2H2(g)![]() C(s)+ 2H2O(g) △H =-90.0kJ/mol ;H2O(1)=H2O(g) △H =+44.0kJ/mol; C(s)的燃烧热为394.0kJ/mol。则H2的燃烧热为_________kJ/mol。
C(s)+ 2H2O(g) △H =-90.0kJ/mol ;H2O(1)=H2O(g) △H =+44.0kJ/mol; C(s)的燃烧热为394.0kJ/mol。则H2的燃烧热为_________kJ/mol。
(3)在某条件下,将4molH2和1molCO2,置于2L密闭容器中发生反应:
反应II :CO2(g)+4H(g) ![]() CH4(g)+2H2O(g) △H2
CH4(g)+2H2O(g) △H2
反应Ⅲ: CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
CO2转化率、CH4和CO 选择性随温度变化情况分别如图所示(选择性: 转化的CO2中生成CH4或CO 的百分比)。
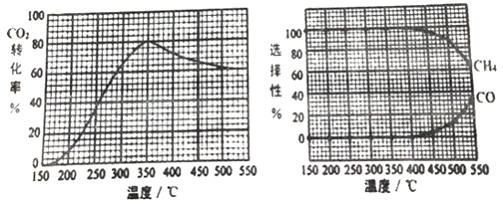
①反应II的△H2________(填“>”、“<“或“=")0,理由是_________________________。
②350℃时,反应II 的平衡常数K=_______。为减少CO 在产物中的比率,可采取______的措施有______(例举一例回答)。
【答案】 0.135mol·L-1·min-1 b d 286.0或ΔH =-286.0 < 平衡后升高温度,CO2的转化率降低,可知该平衡向逆反应方向移动,故该反应为放热反应 100 增大压强
【解析】(1) CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
起始(mol) 1.5 3 0 0
反应(mol)1.5×60% 3×1.5×60% 1.5×60% 1.5×60%
平衡(mol) 0.6 0.3 0.9 0.9
v(H2)= =0.135mol·L-1·min-1;a.升高温度,平衡逆向移动,甲醇的产量减少,错误;b.缩小容器体积,压强增大,反应速率增大,平衡正向移动,甲醇的产量增大,正确;c.分离出甲醇,甲醇的浓度减小,反应速率减慢,错误;d.增加CO2的浓度,反应速率增大,平衡正向移动,甲醇的产量增大,正确;故选bd,故答案为:0.135mol·L-1·min-1;b d;
=0.135mol·L-1·min-1;a.升高温度,平衡逆向移动,甲醇的产量减少,错误;b.缩小容器体积,压强增大,反应速率增大,平衡正向移动,甲醇的产量增大,正确;c.分离出甲醇,甲醇的浓度减小,反应速率减慢,错误;d.增加CO2的浓度,反应速率增大,平衡正向移动,甲醇的产量增大,正确;故选bd,故答案为:0.135mol·L-1·min-1;b d;
(2)①CO2(g)+2H2(g)C(s)+2H2O(g)△H=-90.0kJ/mol,②H2O(1)═H2O(g)△H=+44.0kJ/mol,C(s)的燃烧热△H=-394.0kJmol-1,故热化学方程式为③C(s)+O2(g)=CO2(g)△H=-394.0kJ/mol, ![]() ×①+
×①+![]() ×③-②得,H2(g)+
×③-②得,H2(g)+ ![]() O2(g)=H2O(l)△H=-286kJ/mol,故答案为:286或△H=-286;
O2(g)=H2O(l)△H=-286kJ/mol,故答案为:286或△H=-286;
(3)①反应II达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应,故<0;原因是反应Ⅰ达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应,故答案为:<;反应II达到平衡状态后,随温度升高二氧化碳平衡转化率减小,说明正反应为放热反应;
② CO2(g)+4H2(g)CH4(g)+2H2O(g)
开始(mol) 1 40 0
变化(mol)0.83.2 0.81.6
平衡(mol)0.20.8 0.8 1.6,
则c(CO2)= ![]() =0.1mol/L,c(H2)=
=0.1mol/L,c(H2)= ![]() =0.4mol/L,c(CH4)=
=0.4mol/L,c(CH4)= ![]() =0.4mol/L,c(H2O)=
=0.4mol/L,c(H2O)= ![]() =0.8mol/L,则K=
=0.8mol/L,则K=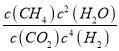 =
=![]() =100,由图像知,为减少CO在产物中的比率,可采取的措施有增加压强或降低温度,故答案为:100;增加压强。
=100,由图像知,为减少CO在产物中的比率,可采取的措施有增加压强或降低温度,故答案为:100;增加压强。

 高中必刷题系列答案
高中必刷题系列答案