��Ŀ����
����Ŀ����ϩ�ڴ����������¿ɷ���������Ӧ���䷴Ӧ����Ϊ��PdCl2+C2H4+H2O![]() Pd+2HCl+CH3CHO��Pd+2CuCl2 PdCl2+2CuCl��4CuCl+4HCl+O2 4CuCl2+2H2O������˵���������
Pd+2HCl+CH3CHO��Pd+2CuCl2 PdCl2+2CuCl��4CuCl+4HCl+O2 4CuCl2+2H2O������˵���������
A. �����ӿ췴Ӧ���ʵ�ԭ����ͨ���ı䷴Ӧ·�������˻��
B. �ô�������Ӧ���ܷ���ʽ��2C2H4+O2![]() 2CH3CHO
2CH3CHO
C. �ô��������̿�����ˮ�����½���
D. CuCl2��PdCl2�Ļ����Һ����Ϊ�÷�Ӧ�Ĵ���
���𰸡�C
��������
A. �������Ըı䷴Ӧ��·�����뷴Ӧ���γɻ�м�������·���������йء���ܵ���:Ea = ��м����������� - ��Ӧ���ƽ�������������ı�·��ʹ����������С������ܱ�С����A��ȷ��
B. ���ݷ�Ӧ������PdCl2��CuCl2Ϊ�÷�Ӧ�Ĵ���������Ӧ������ʽ�ϲ��ɵã��ô�������Ӧ���ܷ���ʽ��2C2H4+O2![]() 2CH3CHO����B��ȷ��
2CH3CHO����B��ȷ��
C. ���ݷ�Ӧ����PdCl2+C2H4+H2O![]() Pd+2HCl+CH3CHO���ô�����������ˮ���뷴Ӧ����C����
Pd+2HCl+CH3CHO���ô�����������ˮ���뷴Ӧ����C����
D. ���ݷ�Ӧ�������̣�PdCl2��CuCl2Ϊ�÷�Ӧ�Ĵ�������D��ȷ��
��ѡC��

 ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д� �ƸԴ��ž�ϵ�д�
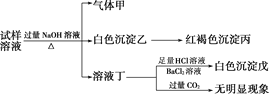
�ƸԴ��ž�ϵ�д�����Ŀ������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
����a | ��̿���ڸ��������»�ԭCuO |
����b | �������ǻ�ԭ���Ƶ�Cu(OH)2�Ʊ�Cu2O |
����c | ��ⷨ����ӦΪ2Cu+H2O |
����d | ����(N2H4)��ԭ���Ƶ�Cu(OH)2 |
��1����֪����2Cu��s��+![]() O2��g����Cu2O��s������H����169kJmol��1
O2��g����Cu2O��s������H����169kJmol��1
��C��s��+![]() O2��g����CO��g������H����110.5kJmol��1
O2��g����CO��g������H����110.5kJmol��1
��Cu��s��+![]() O2��g����CuO��s������H����157kJmol��1
O2��g����CuO��s������H����157kJmol��1
��a�������Ȼ�ѧ����ʽ�ǣ�_____��
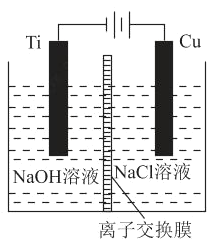
��2������c�������ӽ���Ĥ���Ƶ��Һ��OH����Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ��
�����ӽ���ĤΪ_____���ӽ���Ĥ�����������������������õ�ص�������ӦʽΪ_____���Ѽ�������pHֵ_____����������������С����������������
��3������dΪ������������Һ̬�£�N2H4����ԭ����Cu��OH��2���Ʊ�����Cu2O��ͬʱ�ų�N2�����Ʒ��Ļ�ѧ����ʽΪ_____��
��4������ͬ���ܱ������У������Ϸ����Ƶõ�����Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺
2H2O��g��![]() 2H2��g��+O2��g����H��0��ˮ������Ũ����ʱ��t�仯���±���ʾ��
2H2��g��+O2��g����H��0��ˮ������Ũ����ʱ��t�仯���±���ʾ��

���Ա�ʵ����¶ȣ�T2_____T1�����������������������������ܷ�ͨ���Ա�ʵ���٢�����ƽ������ʱ�䳤���жϣ�_____����������������������
��ʵ����ǰ20min��ƽ����Ӧ���� v��O2����_____
�������Ĵ�Ч�ʣ�ʵ����_____ʵ��������������������������