题目内容
【题目】某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
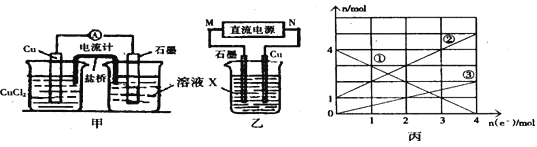
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是 ;②Cu电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 离子(填“K+”或“Cl—”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是 极;②图丙中的②线是 离子的变化。
③当电子转移为2mol时,向乙烧杯中加入 L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O![]() Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。
③Na2FeO4能消毒、净水的原因 。
【答案】(1)①FeCl3 ; ②Cu-2e-=Cu2+ ; ③K+
(2)①负;②Fe2+(或者FeCl2);③2.8
(3)①Fe+8OH――6e-=FeO42-+4H2O
②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
③高价铁具有氧化性,能杀菌消毒,生成的Fe3+水解形成胶体,具有吸附悬浮物的净水作用。
【解析】
试题分析:(1)①据反应物和生成物可以确定该反应为2FeCl3+Cu═2FeCl2+CuCl2,所以X为FeCl3溶液,故答案为:FeCl3;
②Cu做负极,Cu电极上发生的电极反应式为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
③Cu做负极,石墨作正极,盐桥中阳离子向正极移动,则K+不断移向正极即进入X溶液中,故答案为:K+;
(2)①根据丙图可知溶液中有三种金属阳离子,而根据X的成分可知X中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此Cu做阳极,石墨做阴极,则M为负极,N为正极;故答案为:负;
②在电解过程中有Cu2+生成,则Cu2+的物质的量从零逐渐增大,所以③为Cu2+,由图可知,①表示的金属离子的物质的量正极减少,则为Fe3+,所以②为Fe2+,故答案为:Fe2+;
③当电子转移为2mol时,溶液中有Fe3+ 2mol,Fe2+ 3mol,Cu2+为1mol,所以需要加入NaOH溶液14mol,所以NaOH溶液等体积为![]() =2.8L,故答案为:2.8;
=2.8L,故答案为:2.8;
(3)①电解时阳极发生氧化反应,电极反应方程式为Fe+8OH—6e-═FeO42-+4H2O,故答案为:Fe+8OH—6e-═FeO42-+4H2O;
②NaClO氧化Fe(OH)3的反应方程式为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,故答案为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O;
③高价铁具有氧化性,能杀菌消毒,生成的Fe3+水解形成胶体,具有吸附悬浮物的净水作用,故答案为:高价铁具有氧化性,能杀菌消毒,生成的Fe3+水解形成胶体,具有吸附悬浮物的净水作用。

 阅读快车系列答案
阅读快车系列答案