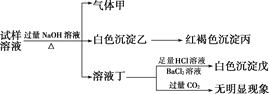
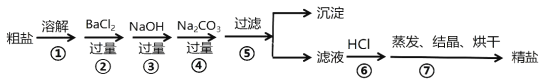
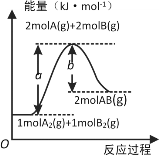
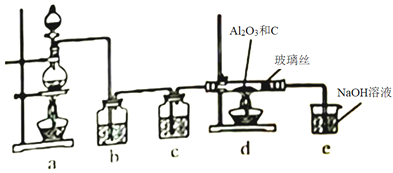
题目内容
【题目】(1)将a mol Cl2 通入含b mol FeBr2的溶液中,当0< a / b≤1/2 时,反应的离子方程式为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl- ,写出另2个可能发生的离子方程式。
①当 a / b =1时___;②当a / b≥3/2时_______。
(2)观察反应①②,总结规律,并模仿反应①②方程式完成下列问题:①Al(OH)3 +H2O![]() Al(OH)4― + H+;②NH3+H2O
Al(OH)4― + H+;②NH3+H2O![]() NH4+ + OH―。
NH4+ + OH―。
(A)已知B(OH)3是一元弱酸,试写出其电离方程式: ___;
(B)N2H4是二元弱碱,其电离分步进行,第一步电离方程式N2H4+H2O![]() N2H5+ + OH―,试写出其第二步电离方程式_____。
N2H5+ + OH―,试写出其第二步电离方程式_____。
【答案】2Cl2 + 2Fe2+ + 2Br― = 4Cl―+ 2Fe3+ + Br2 3Cl2 + 2Fe2+ + 4Br―=2Fe3+ + 2Br2 + 6Cl― B(OH)3+H2O![]() B(OH)4― + H+ N2H5+ +H2O
B(OH)4― + H+ N2H5+ +H2O![]() N2H62+ + OH―
N2H62+ + OH―
【解析】
(1)根据还原性顺序:Fe2+ > Br―,进行反应,书写离子方程式;
(2)(A)已知B(OH)3是一元弱酸,Al与B为同主族元素,则与Al的电离相同;
(B)N2H4是二元弱碱,第二步电离方程式为N2H5+ +H2O![]() N2H62+ + OH―。
N2H62+ + OH―。
(1)还原性:Fe2+ > Br―, ①当 a / b =1时,氯气与亚铁离子反应完毕后,继续与溴离子反应,方程式为2Cl2 + 2Fe2+ + 2Br― = 4Cl―+ 2Fe3+ + Br2;②当a / b≥3/2,FeBr2完全反应,离子方程式为3Cl2 + 2Fe2+ + 4Br―=2Fe3+ + 2Br2 + 6Cl―;
(2)(A)已知B(OH)3是一元弱酸,Al与B为同主族元素,则与Al的电离相同,电离方程式为B(OH)3+H2O![]() B(OH)4― + H+;
B(OH)4― + H+;
(B)N2H4是二元弱碱,第二步电离方程式为N2H5+ +H2O![]() N2H62+ + OH―。
N2H62+ + OH―。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案