��Ŀ����
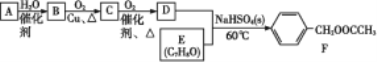
����Ŀ���л���F��һ����;�㷺������,������A���л���EΪԭ��,�����������̽��кϳɡ���֪A�ڱ�״���µ��ܶ�Ϊ1.25 g��L-1��
�ش���������:
(1)�л���F�к��еĹ���������Ϊ____��
(2)A����B�ķ�Ӧ����Ϊ________��
(3)д��������B����C�Ļ�ѧ����ʽ_______��
(4)����˵����ȷ����____��
A ����ͼ���л���Bת��ΪC��Cu�����˻�ѧ��Ӧ,����Ӧǰ����������ֲ���
B �л���C������ʹ��ˮ��ɫ
C �л���D��E����F�ķ�ӦΪ������Ӧ,��������ȡ����Ӧ
D �ϳɹ�����ԭ�ӵ�����������Ϊ100%�ķ�Ӧֻ��һ��
���𰸡����� �ӳɷ�Ӧ 2CH3CH2OH+O2![]() 2CH3CHO+2H2O AC
2CH3CHO+2H2O AC
��������
��A�ڱ�״���µ��ܶȿ������A����Է�������Ϊ22.4 L��mol-1��1.25 g��L-1=28 g��mol-1��A ΪCH2=CH2����ˮ�ӳ������Ҵ���BΪCH3CH2OH���Ҵ�������������ȩ��CΪCH3CHO����ȩ�ٴ�����Ϊ���ᣬDΪCH3COOH��FΪ���ᱽ�������������E���ɣ���EΪ���״���
��1��F���������еĹ�����Ϊ������
��2����ϩ�����Ҵ��Ƿ�������ϩ��ˮ�ļӳɷ�Ӧ���ʷ�Ӧ����Ϊ�ӳɷ�Ӧ��
��3���Ҵ�������������ȩ�Ļ�ѧ����ʽΪ��2CH3CH2OH+O2![]() 2CH3CHO+2H2O��
2CH3CHO+2H2O��
��4��A.�Ҵ�ת��Ϊ��ȩ�ķ�Ӧ�У�Cu�Ǵ�����Cu�Ⱥ���������CuO��CuO�ٺ��Ҵ�����Cu����ȩ������Cu�����˻�ѧ��Ӧ,����Ӧǰ����������ֲ��䣬��A��ȷ��
B.��ȩ�л�ԭ�ԣ����Ա���ˮ�е��������Ӷ�ʹ��ˮ��ɫ����B����
C.����ͱ��״��������ᱽ�����ķ�Ӧ��������Ӧ����������ȡ����Ӧ����C��ȷ��
D.�ϳɹ�����ԭ�ӵ�����������Ϊ100%�ķ�Ӧ��2�����ֱ�����ϩ�ӳ������Ҵ�����ȩ������Ϊ���ᡣ��D����
��ѡAC��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����2 L���ܱ������ڣ�800��ʱ��Ӧ2NO(g)��O2(g)2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K��___________________________����֪��K300��>K350������÷�Ӧ��______�ȷ�Ӧ��
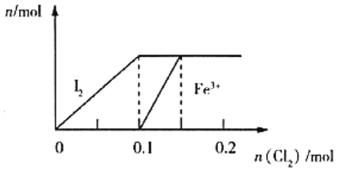
��2����ͼ��ʾNO2�仯��������____����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��_________��

��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
a��v(NO2)��2v(O2) b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2) d���������ܶȱ��ֲ���
��4��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����________������������������������������������
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч����