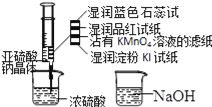
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ÷Τ±Η–Ω”ΓΥΔΒγ¬ΖΑε «”ΟœΓœθΥαΗ· ¥–ΩΑε≤ζ…ζΒΡΖœ“Κ≥ΤΓΑάΟΑε“ΚΓ±ΓΘΓΑάΟΑε“ΚΓ±÷–≥ΐΚ§œθΥα–ΩΆβΘ§ΜΙΚ§”–Ή‘ά¥Υ°¥χ»κΒΡClΘ≠ΚΆFe3+Θ§‘Ύ Β―ι “άοΘ§”ΟΓΑάΟΑε“Κ÷Τ»ΓZnSO47H2OΒΡΙΐ≥Χ»γΆΦΥυ Ψ
Θ®1Θ©»τœΓœθΥαΗ· ¥–ΩΑε ±ΜΙ‘≠≤ζΈοΈΣN2OΘ§―θΜ·ΦΝ”κΜΙ‘≠ΦΝΒΡΈο÷ ΒΡΝΩ÷°±» «____ΓΘ
Θ®2Θ©»τ≤Ϋ÷ηΔΌΒΡpHΘΨ12Θ§‘ρZn(OH) 2»ήΫβ…ζ≥…ΥΡτ«ΜυΚœ–ΩΥαΡΤΘ§Zn(OH) 2»ήΫβΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_____ΓΘ
Θ®3Θ©¬Υ“ΚD÷–≥ΐΝΥΚ§”–OH-άκΉ”ΆβΘ§ΜΙΚ§”–ΒΡ“θάκΉ””–___________Θ®ΧνάκΉ”ΖϊΚ≈Θ©ΓΘ
Θ®4Θ©»τ¬Υ“ΚEΒΡpHΘΫ4Θ§c(Zn2ΘΪ)ΘΫ2molΓΛL-1,c(Fe3ΘΪ)ΘΫ2.6ΓΝ10-9moΓΛL-l ‘«σ≥ωFe(OH)3ΒΡ»ήΕ»Μΐ≥Θ ΐ__Θ®÷Μ–η–¥≥ωΫαΙϊΦ¥Ω…Θ©ΓΘ
Θ®5Θ©“―÷Σ:ΔΌFe(OH)3Θ®sΘ© Fe3ΘΪΘ®aqΘ©ΘΪ3OHΘ≠Θ®aqΘ©HΘΫa kJ molΓΛL-1ΔΎH2O(l) HΘΪΘ®aqΘ©ΘΪOHΘ≠Θ®aqΘ©HΘΫb kJΓΛmolΓΛL-1Θ§»τΔΌΒΡ»ήΕ»Μΐ≥Θ ΐΈΣKspΘ§ΔΎΒΡάκΉ”Μΐ≥Θ ΐΈΣKwΘ§Fe3ΘΪΖΔ…ζΥ°ΫβΖ¥”ΠΒΡΤΫΚβ≥Θ ΐ:KΘΫ____Θ®”ΟΚ§KwΓΔKspΒΡ¥ζ ΐ Ϋ±μ ΨΘ©ΓΘ
ΓΨ¥πΑΗΓΩ1:2 Zn(OH)2+2OH=[Zn(OH)4]2 ClΓΔNO3 2.6ΓΝ10-39 ![]()
ΓΨΫβΈωΓΩ
ΗυΨί Β―ιΡΩΒΡΦΑΝς≥ΧΆΦΖ÷ΈωΗς≤ΫΖΔ…ζΒΡΖ¥”ΠΦΑ≥ΝΒμΉι≥…Θ§ ι–¥œύΙΊΖ¥”ΠάκΉ”ΖΫ≥Χ ΫΘΜΗυΨίΒγάκΦΑΥ°Ϋβ‘≠άμΘ§‘Υ”ΟΤΫΚβ≥Θ ΐ±μ¥ο ΫΫχ––œύΙΊΦΤΥψΓΘ
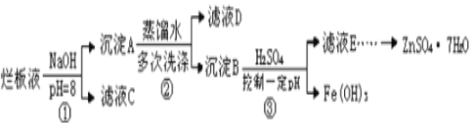
“ρΈΣΖœ“Κ «”ΟœΓœθΥαΗ· ¥–ΩΑεΚσΒΟΒΫΒΡΘ§Υυ“‘Ζœ“Κ÷–Κ§”–¥σΝΩΒΡ–ΩάκΉ”ΓΔ«βάκΉ”ΓΔœθΥαΗυάκΉ”ΚΆ…ΌΝΩΒΡClΓΔFe3+Θ§Φ”»κ«β―θΜ·ΡΤΒςΫΎ»ή“ΚΒΡpH=8 ΙΧζάκΉ”ΓΔ–ΩάκΉ”Άξ»Ϊ≥ΝΒμΘ§»ΜΚσ‘Ύ≥ΝΒμB÷–Φ”ΝρΥα≤ΔΩΊ÷ΤpHΘ§ Ι«β―θΜ·Χζ≥ΝΒμΘ§–ΩάκΉ”»ήΫβΒΟΒΫΝρΥα–Ω»ή“ΚΘ§Ήν÷’ΒΟΒΫΝρΥα–ΩΨßΧεΘΜ
(1)»τœΓœθΥαΗ· ¥–ΩΑε ±ΜΙ‘≠≤ζΈοΈΣN2OΘ§‘ρΖ¥”ΠΒΡΖΫ≥Χ ΫΈΣ4Zn+10HNO3=4Zn(NO3)2+N2OΓϋ+5H2OΘ§”…ΖΫ≥Χ ΫΩ…÷ΣΖ¥”Π÷–HNO3ΈΣ―θΜ·ΦΝΘ§ZnΈΣΜΙ‘≠ΦΝΘ§Β±4molZn≤ΈΦ”Ζ¥”Π ±Θ§”–2molHNO3±ΜΜΙ‘≠Θ§‘ρ―θΜ·ΦΝ”κΜΙ‘≠ΦΝΒΡΈο÷ ΒΡΝΩ÷°±»1:2Θ§Ι ¥πΑΗΈΣΘΚ1:2ΘΜ
(2)Zn(OH)2»ήΫβ…ζ≥…ΥΡτ«ΜυΚœ–ΩΥαΡΤΘ§Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣZn(OH)2+2OH=[Zn(OH)4]2Θ§
Ι ¥πΑΗΈΣΘΚZn(OH)2+2OH=[Zn(OH)4]2ΘΜ
(3)ΙΧΧεΨΏ”–ΈϋΗΫ–‘Θ§≥ΝΒμAΩ…ΈϋΗΫ»ή“Κ÷–ΒΡClΓΔNO3Β»άκΉ”Θ§‘ρ¬Υ“Κ÷–”ΠΚ§”–ClΓΔNO3Θ§Ι ¥πΑΗΈΣΘΚClΓΔNO3ΘΜ
Θ®4Θ©»τ¬Υ“ΚEΒΡpHΘΫ4Θ§‘ρc(OH-)ΘΫ1ΓΝ10-10moΓΛL-lΘ§ΒΟΒΫΒΡ≥ΝΒμΈΣFe(OH)3Θ§‘ρFe(OH)3ΒΡ»ήΕ»Μΐ≥Θ ΐΈΣΘΚ![]() Θ§Ι ¥πΑΗΈΣΘΚ2.6ΓΝ10-39ΘΜ
Θ§Ι ¥πΑΗΈΣΘΚ2.6ΓΝ10-39ΘΜ
Θ®5Θ©Fe3+ΖΔ…ζΥ°ΫβΖ¥”ΠΒΡΖΫ≥Χ ΫΈΣFe3++3H2O![]() Fe(OH)3+3H+Θ§“―÷ΣΔΌFe(OH)3Θ®sΘ© Fe3ΘΪΘ®aqΘ©ΘΪ3OHΘ≠Θ®aqΘ©
Fe(OH)3+3H+Θ§“―÷ΣΔΌFe(OH)3Θ®sΘ© Fe3ΘΪΘ®aqΘ©ΘΪ3OHΘ≠Θ®aqΘ©![]() Θ§ ΔΎH2O(l) HΘΪΘ®aqΘ©ΘΪOHΘ≠Θ®aqΘ©
Θ§ ΔΎH2O(l) HΘΪΘ®aqΘ©ΘΪOHΘ≠Θ®aqΘ© ![]() Θ§‘ρΔΎΓΝ3ΔΌΩ…ΒΟFe3+(aq)+3H2O(l)Fe(OH)3(aq)+3H+(aq)Θ§‘ρFe3+ΖΔ…ζΥ°ΫβΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣΘΚ
Θ§‘ρΔΎΓΝ3ΔΌΩ…ΒΟFe3+(aq)+3H2O(l)Fe(OH)3(aq)+3H+(aq)Θ§‘ρFe3+ΖΔ…ζΥ°ΫβΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣΘΚ![]() Θ§Ι ¥πΑΗΈΣΘΚ
Θ§Ι ¥πΑΗΈΣΘΚ![]() ΓΘ
ΓΘ

 Ϋπ‘Ω≥Ή ‘ΨμœΒΝ–¥πΑΗ
Ϋπ‘Ω≥Ή ‘ΨμœΒΝ–¥πΑΗ