题目内容
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷直接脱氢制丙烯发生的反应有:
反应Ⅰ:C3H8(g)C3H6(g)+H2(g) △H1
反应Ⅱ:2C3H8(g)3C2H4(g)+2H2(g) △H2
已知:①反应Ⅰ活化能Ea(Ⅰ)小于反应Ⅱ活化能Ea(Ⅱ);
②3种物质的燃烧热如下表:
C3H8(g) | C3H6(g) | H2(g) |
—2217.8kJ·mol-1 | —2058kJ·mol-1 | —285.8kJ·mol-1 |
(1)△H1=_______kJ·mol-1
(2)恒温恒容条件下,向密闭容器中充入1molC3H8(g),下列情况能说明丙烷脱氢制丙烯反应达到平衡状态的是______________。
A.该反应的H保持不变B.混合气体的平均摩尔质量保持不变
C.![]() 保持不变D.C3H8分解速率与C3H6消耗速率相等
保持不变D.C3H8分解速率与C3H6消耗速率相等
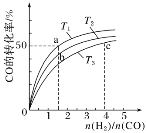
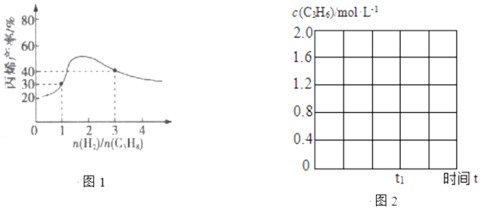
(3)一定温度下,向恒容密闭容器中充入总物质的量为4mol的丙烷和氢气混合气体(氢气的作用是活化催化剂)。反应相同时间,丙烯产率与进料气的关系如图1所示。图中曲线升高的原因是______________。
(4)①反应温度600℃,将10molC3H8(g)充入2L的刚性容器中,丙烷平衡转化率与丙烯的选择性均为40%,则反应Ⅰ的平衡常数K=______________。(保留2位小数)(丙烯的选择性=![]() ×100%)
×100%)
②600℃,丙烷脱氢反应在t1时达平衡,请在图2中画出该条件下c(C3H6)随时间t的变化图。______________
(5)含一氯丙烷(C3H7Cl)的废水可通过加入适量乙酸钠,设计成微生物电池除去,其原理如图3所示。写出N电极的电极反应式______________。

【答案】+126.0 BD 增大氢气的量能提高催化剂的活性,从而提高丙烯的产率 0.53 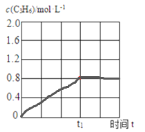
![]()
【解析】
(1)根据盖斯定律进行计算;
(2)反应达到平衡状态时,正逆反应速率相等,各物质的浓度、含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到不变时,说明可逆反应到达平衡状态;
(3)由题意可知氢气的作用是活化催化剂,增大氢气的量能提高催化剂的活性,从而提高丙烯的产率,继续通氢气会使平衡逆向移动,从而减小丙烯的产率;
(4) 10molC3H8(g)充入2L的刚性容器中,丙烷平衡转化率与丙烯的选择性均为40%,丙烷的平衡物质的量为![]() ,丙烯的平衡量为
,丙烯的平衡量为![]() ;由反应可知无论发生哪个反应消耗的丙烷的物质的量都等于产生氢气的物质的量,计算出平衡时氢气的物质的量,带入反应I的平衡常数K的计算公式进行计算;
;由反应可知无论发生哪个反应消耗的丙烷的物质的量都等于产生氢气的物质的量,计算出平衡时氢气的物质的量,带入反应I的平衡常数K的计算公式进行计算;
②600℃,丙烷脱氢反应在t1时达平衡,此时丙烯的浓度为0.8mol/L,据此画出c(C3H6)随时间t的变化图;
(5)由图示信息可知,N电极上的反应为醋酸根转变成二氧化碳,且电解质环境为酸性,据此写出极反应方程式。
(1)结合燃烧热的概念及相关物质的燃烧热数值,可得以下热化学方程式:
①![]() ;
;
②![]() ;
;
③![]() ;
;
由盖斯定律可知反应I可由①-②-③得到,则△H1=△H3-△H4-△H5=(-2217.8kJ·mol-1)-(-2058kJ·mol-1)-(-285.8kJ·mol-1)=+126.0 kJ·mol-1;
故答案为:+126.0
(2) A.焓变(△H)只与化学反应有关,所以反应的焓变(△H)始终保持不变,即反应的焓变(△H)保持不变不能说明反应达到平衡状态,故A错误;
B.无论发生反应I还是反应II,其他的总质量保持不变,气体的物质的量变化,则混合气体的平均摩尔质量是变量,当混合气体的平均摩尔质量保持不变时反应达到平衡状态,B选;
C.![]() 为反应I的平衡常数,K只受温度影响,温度不变K不变,不能根据K不变判断平衡状态,C不选;
为反应I的平衡常数,K只受温度影响,温度不变K不变,不能根据K不变判断平衡状态,C不选;
D.C3H8分解速率与C3H6消耗速率相等说明正逆反应速率相等,反应达到平衡状态,故D选;
故答案为:BD。
(3)由题意可知氢气的作用是活化催化剂,增大氢气的量能提高催化剂的活性,从而提高丙烯的产率,继续通氢气会使平衡逆向移动,从而减小丙烯的产率,
故答案为:增大氢气的量能提高催化剂的活性,从而提高丙烯的产率;
(4) 10molC3H8(g)充入2L的刚性容器中,丙烷平衡转化率与丙烯的选择性均为40%,丙烷的平衡物质的量为![]() ,丙烯的平衡量为
,丙烯的平衡量为![]() ;由反应可知无论发生哪个反应消耗的丙烷的物质的量都等于产生氢气的物质的量,则平衡时氢气的物质的量为:4mol,反应I的平衡常数K=
;由反应可知无论发生哪个反应消耗的丙烷的物质的量都等于产生氢气的物质的量,则平衡时氢气的物质的量为:4mol,反应I的平衡常数K=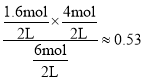 ;
;
故答案为:0.53;
②600℃,丙烷脱氢反应在t1时达平衡,此时丙烯的浓度为0.8mol/L, 该条件下c(C3H6)随时间t的变化图 ;
;
故答案为: ;
;
(5)由图示信息可知,N电极上的反应为醋酸根转变成二氧化碳,且电解质环境为酸性,反应式为:![]() ;
;
故答案为:![]() 。
。