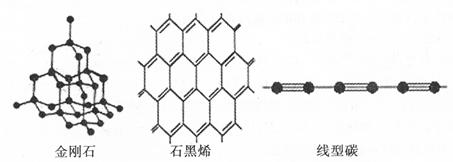
题目内容
下列说法不正确的是
| A.反应C(s)+CO2(g)=2CO(g);△H>0,在任何条件下均不能自发进行 |
| B.铅蓄电池在放电过程中,溶液的PH值增加 |
| C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小 |
| D.温度一定时,水的离子积常数Kw不随外加酸(碱)浓度的改变而改变 |
A
根据方程式可知,反应是熵值增加的、吸热的可逆反应,所以根据△G=△H-T·△S可知,反应应该在高温下自发进行,A不正确,其余都是正确的,答案选A。

练习册系列答案
相关题目

 Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;

 N2O4(g) △H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,若 c (NO2) =" 0.0300" mol·L-1,
N2O4(g) △H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,若 c (NO2) =" 0.0300" mol·L-1, 的原料。已知:
的原料。已知: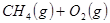
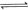



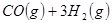




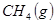 与
与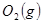 反应生成
反应生成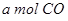 与
与 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示: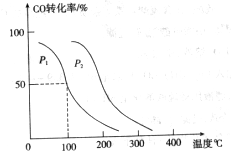

 (填“<”、“>”或“=”)
(填“<”、“>”或“=”) 、
、 的代数式表示)。
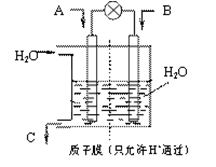
的代数式表示)。 电极通入的
电极通入的 为 ,电极反应式是 。
为 ,电极反应式是 。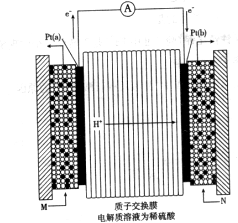
 溶液,当得到
溶液,当得到 铜时,参加反应的气体
铜时,参加反应的气体 的体积应为
的体积应为  (标准状况)。
(标准状况)。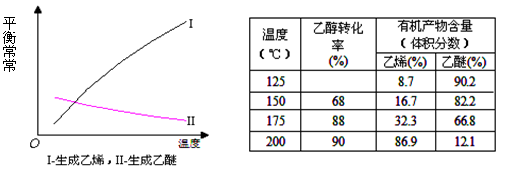
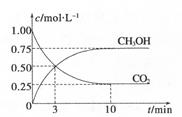
 CH3OH(g)+H2O(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。