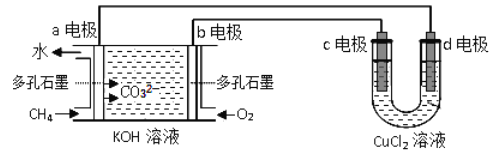
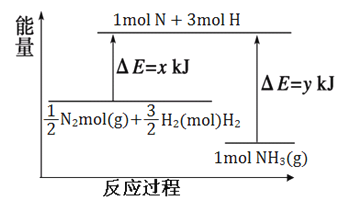
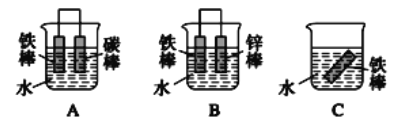
��Ŀ����
����Ŀ��ij��ѧ��Ӧ2A![]() B + D�����ֲ�ͬ�����½��У�B��D����ʼŨ��Ϊ0����Ӧ��A��Ũ�ȣ�mol/L���淴Ӧʱ�䣨min���ı仯������±���ʾ�������¶�Ϊ���϶ȣ��棩��
B + D�����ֲ�ͬ�����½��У�B��D����ʼŨ��Ϊ0����Ӧ��A��Ũ�ȣ�mol/L���淴Ӧʱ�䣨min���ı仯������±���ʾ�������¶�Ϊ���϶ȣ��棩��
ʵ�� ��� | Ũ�� ʱ�� �¶� | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1. 0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
���������ݣ��ش��������� ��
��1����ʵ��1�У��Է�Ӧ��AŨ�ȵı仯��ʾ�÷�Ӧ��0~10min�ڵ�ƽ����Ӧ����Ϊ________ ��
��2����ʵ��1�У�c1��ֵΪ ________ ��
��3����ʵ��1��2����һ��ʵ��ʹ�������������ж���ʵ�� ________ ��ѡ�1����2����ʹ������������
��4����ʵ��1��3�з�Ӧ�¶Ȳ�ͬ���ж�T3 ________ 800��ѡ���������������
���𰸡� 0.02 mol/(L��min)��0.02 mol��L-1��min-1 0.50 2 ��
�����������⿼�黯ѧ��Ӧ���ʵļ��㣬�Լ�Ӱ�컯ѧ��Ӧ���ʵ����أ���1�����ݻ�ѧ��Ӧ���ʵ���ѧ����ʽ��c(A)=(1��0.8)/10mol/(L��min)=0.02 mol/(L��min)����2�����ݱ������ݣ�ʵ��1��40min�ﵽƽ�⣬���c1=0.50mol��L��1����3��ʹ�ô������ӿ췴Ӧ���ʣ��ﵽƽ�����õ�ʱ��϶̣�ʵ��1��40min�ﵽƽ�⣬ʵ��2��20min�ﵽƽ�⣬���ʵ��2ʹ��������������4��ʵ��3��0��10minʱ��A�ķ�Ӧ������v(A)=(1��0.4)/10 mol/(L��min)=0.06 mol/(L��min)����Ӧ���ʴ���ʵ��1�������¶ȣ���ѧ��Ӧ���ʼӿ죬���T3>800�档

����Ŀ����֪H2(g)+Br2(l)=2HBr(g)����H=-72kJ/mol������1mol Br2(l)��Ҫ���յ�����Ϊ30kJ����������������±���
��ѧ���� | H2(g) | Br2(g) | HBr(g) |
1mol�����еĻ�ѧ������ʱ��Ҫ���յ�����/KJ | 436 | a | 369 |
�����a��������
A��404 B��260 C��230 D��200
����Ŀ�������£���һԪ��HA����Һ��KOH��Һ��������(��������仯)��ʵ���������±���
ʵ���� | ��ʼŨ��/mol��L-1 | ��Ӧ����Һ��PH | |
c(HA) | c(KOH) | ||
�� | 0.1 | 0.1 | 9 |
�� | X | 0.2 | 7 |
�����ж�����ȷ����
A. ʵ��ٷ�Ӧ�����Һ�У�c(K+)>c(A-)>c(OH-)>c(H+)
B. ʵ��ٷ�Ӧ�����Һ�У�c(OH-)= c(K+)-c(A_)=![]() mol��L-1
mol��L-1
C. ʵ��ڷ�Ӧ�����Һ�У�c(A-)+c(HA)>0.1mol��L-1
D. ʵ��ڷ�Ӧ�����Һ�У�c(K+)=c(A-)> c(OH-)=c(H+)