题目内容
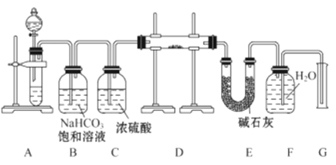
【题目】用下列实验装置进行的实验,能达到相应实验目的的是()
A. 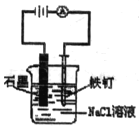 防止铁钉生锈
防止铁钉生锈
B. 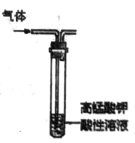 除去乙烷中混有的乙烯
除去乙烷中混有的乙烯
C. 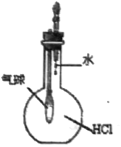 验证HCl气体在水中的溶解性
验证HCl气体在水中的溶解性
D. 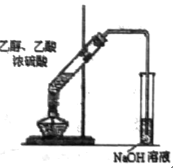 实验室制取乙酸乙酯
实验室制取乙酸乙酯
【答案】C
【解析】
A. 该装置为电解池,由于Fe电极与电源的正极连接,为阳极,会加快Fe的腐蚀速率,A错误;
B. 乙烯被酸性高锰酸钾溶液氧化产生CO2气体,不能达到除杂的目的,B错误;
C. HCl极容易溶于水,向盛有HCl气体的集气瓶中滴加几滴水后,烧瓶中气体压强减小,由于气球内与外界大气相通,气球会鼓起胀大,因此可以验证HCl气体在水中的溶解性,C正确;
D. 实验室用乙酸与乙醇在浓硫酸存在条件下混合加热,发生酯化反应产生乙酸乙酯和水,反应产生的酯中混有挥发的乙酸、乙醇,为达到除去杂质,同时降低乙酸乙酯的溶解度,要把导气管伸入到盛有饱和Na2CO3溶液的试管中,且导管口应该靠近液面上方,D错误;
故合理选项是C。

【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g) + 3H2(g) ![]() 2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量a kJ |
② | 2 | 3 | 0 | 放出热量b kJ |
③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是
A. 放出热量关系:a < b <92.4
B. 三个容器内反应的平衡常数:③>①>②
C. 达平衡时氨气的体积分数:①>③
D. N2的转化率:②>①>③
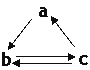
【题目】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 选项 | a | b | c |
A | Al | AlCl3 | Al(OH)3 | |
B | CO2 | Na2CO3 | NaHCO3 | |
C | Si | SiO2 | H2SiO3 | |
D | S | SO3 | H2SO4 |
A. A B. B C. C D. D