题目内容
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g)。在体积2L的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温 度的变化如图所示。下列说法正确的是( )
CH3OH(g)。在体积2L的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温 度的变化如图所示。下列说法正确的是( )
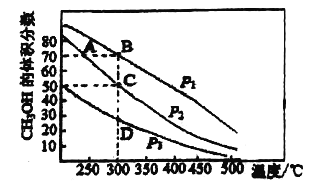
A. 该反应的△H<0,且p1<p2
B. 若p1时最初充入1molCO,经过5min达到B点的平衡状态,此段时间 v(CH3OH)=1.75mol/(L·min)
C. 在C点时,CO转化率为75%
D. A、B、C、D的平衡常数大小关系:A=B>C>D
【答案】C
【解析】
A.根据图像可知,升高温度CH3OH的体积分数下降,则该反应为放热反应,即ΔH<0;由方程式可知增大压强,平衡正向移动,CH3OH的体积分数增大,所以p1>p2,A错误;
B.若p1时最初充入1mol CO,经过5min达到B点的平衡状态,假设CO的转化量为x,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol) 1 2 0
变化(mol) x 2x x
平衡(mol) 1-x 2-2x x
在B点时,CH3OH的体积分数=![]() =70%,解得x=0.875mol,所以此段时间v(CH3OH)=
=70%,解得x=0.875mol,所以此段时间v(CH3OH)=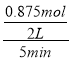 =0.0875mol/(L·min),B错误;
=0.0875mol/(L·min),B错误;
C.设向密闭容器充入了1mol CO和2mol H2,假设CO的转化量为y,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol) 1 2 0
变化(mol) y 2y y
平衡(mol) 1-y 2-2y y
![]() =0.5,解得y=0.75mol,所以CO的转化率为
=0.5,解得y=0.75mol,所以CO的转化率为![]() ×100%=75%,C正确;
×100%=75%,C正确;
D.由图可知,在其它条件不变时,升高温度,CH3OH的含量降低,说明升高温度,平衡逆向移动,逆反应方向为吸热反应,因此该反应的正反应是放热反应,因此温度越高,化学平衡常数越小,温度相同,则化学平衡常数相同,故A、B、C、D的平衡常数大小关系:A>B=C=D ,D错误;
故合理选项是C。

 习题精选系列答案
习题精选系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向盛有某盐溶液的试管中滴入氢氧化钠溶液后,加热,试管口处湿润的红色石蕊试纸变蓝 | 该盐中含 |
B | 向溴水中通入某无色气体,溴水褪色 | 该气体可能是CH2=CH2 |
C | 一定量的铜与硝酸充分反应后,有铜剩余,再加入少量稀硫酸,铜继续溶解,并有气泡放出 | Cu与稀硫酸发生了反应 |
D | 向淀粉溶液中加少量稀硫酸,加热4~5min。冷却后向其中加入新制Cu(OH)2悬浊液,加热至沸腾,无砖红色沉淀 | 淀粉没有发生水解 |
A.AB.BC.CD.D
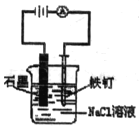
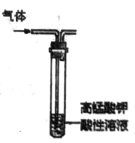
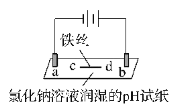
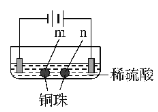
【题目】用石墨电极完成下列电解实验。
实验一 | 实验二 | |
装置 |
|
|
现象 | a 、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近均有气泡产生;铜珠n的右侧有气泡产生。 |
下列对实验现象的解释或推测不合理的是( )
A. 根据实验一的原理,实验二中铜珠m左侧变厚
B. a、d处:2H2O+2e-=H2↑+2OH-
C. b处:2Cl--2e-=Cl2↑;Cl2 + H2O =HCl + HClO
D. c处发生了反应:Fe-2e-=Fe2+