题目内容
【题目】(1)写出明矾[KAl(SO4)212H2O]在水中的电离方程式______________________,明矾净水的原因是因为它与水反应产生_________。
(2)溶液的导电能力大小主要是由离子浓度大小决定的,利用“液体导电性的实验装置”(如右图所示)作下列实验,灯泡能出现由亮—暗—熄灭—亮现象的是______________
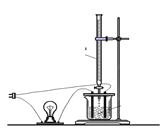
A.向BaCl2溶液中滴入稀H2SO4
B.向Ba(OH)2溶液中滴入稀H2SO4
C.向NaOH溶液中滴入盐酸
写出所选项的离子反应方程式________________________________
(3)Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程。该反应中,被氧化的元素是_______,氧化剂是______。
【答案】 KAl(SO4)2 = K+ + Al3+ + 2SO42- 氢氧化铝胶体 B Ba2++2OH-+2H++ SO42 - =BaSO4↓+2H2O Mn BiO3-
【解析】(1)明矾含有铝离子和钾离子两种阳离子,属于复盐,所以明矾是强电解质,在溶液中完全电离出钾离子、铝离子和硫酸根离子,电离方程式为KAl(SO4)2=K+ +Al3++2SO42-,明矾净水的原因是因为它与水反应产生氢氧化铝胶体,氢氧化铝胶体具有吸附性,能吸附水中的悬浮颗粒,从而起到净水作用。(2)A.向BaCl2溶液中滴入稀H2SO4,生成硫酸钡沉淀和HCl,溶液中离子浓度还是较大,所以灯泡不会熄灭,A错误;B.向Ba(OH)2溶液中滴入稀H2SO4,生成硫酸钡沉淀和水,溶液中离子浓度逐渐减小,灯泡变暗,二者恰好反应时溶液的导电性几乎为零,灯泡熄灭,继续加硫酸,溶液的导电性又增强,灯泡又变亮,B正确;C.向NaOH溶液中滴入盐酸,生成NaCl,溶液中离子浓度变化不大,灯泡不会熄灭,C错误;向Ba(OH)2溶液中滴入稀H2SO4,生成硫酸钡沉淀和水,反应的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;(3)Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程,反应中Bi元素化合价降低,得到电子,BiO3-作氧化剂。Mn元素化合价升高,失去电子,所以该反应中,被氧化的元素是Mn。

【题目】铁及其化合物在生产和生活中有广泛的应用.
(1)铁元素在元素周期表中的位置为 .
(2)等物质的量的铁分别与足量的盐酸、水蒸气在一定条件下反应,产生相同条件下的气体体积比为 ,铁在高温条件下与水蒸气反应的化学方程式为 .
(3)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图: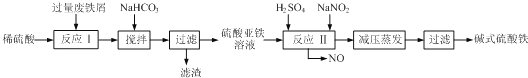
已知:常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
①加入少量NaHCO3的目的是调节pH,应控制pH的范围为 .
②碱式硫酸铁溶于水后产生的[Fe(OH)2+]离子,可部分水解生成聚合离子[Fe2(OH)42+].该水解反应的离子方程式为 .
(4)高铁酸钾(K2FeO4)也是常用的水处理剂.它的制备方法有多种.
①熔融法又称为过氧化钠氧化法.先在高温熔融的条件下制备高铁酸钠:Fe+3Na2O2=Na2FeO4+2Na2O,再将高铁酸钠加入到氢氧化钾溶液里,发生反应:2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析该反应发生的原因: .
②电解法制备高铁酸钾.铁和石墨分别做两个电极的电极材料,氢氧化钠溶液做电解液实现电解制备.阴极的电极材料为 , 写出阳极的电极反应式为 .