题目内容
【题目】用无机矿物资源生产部分材料,其生产流程如图.下列有关说法不正确的是( ) 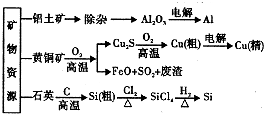
A.Al2O3、SiCl4均为共价化合物
B.生产过程中均涉及氧化还原反应
C.石英可用于制光导纤维,晶体Si常用做半导体材料
D.黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用于冶炼铁
【答案】A
【解析】解:A.SiCl4为共价化合物,氧化铝是由铝离子与氧离子构成的,属于离子化合物,故A错误;B.由氧化铝生产Al时,Al的化合价发生变化,黄铜矿制备Cu时,Cu的化合价发生变化,石英与C反应生成Si时,Si元素的化合价发生变化,所以均是氧化还原反应,故B正确;
C.石英可用于制光导纤维,晶体Si的导电性介于导体与绝缘体之间,常用做半导体材料,故C正确;
D.SO2可以转化成SO3 , 进而生成H2SO4;FeO与CO在高温下可生成Fe,故D正确.
故选A.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案【题目】某校课外活动小组为了探讨铜与硝酸的反应设计了如下实验。
(1)甲同学欲探究铜与稀硝酸反应产生的气体主要是NO,设计装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是含有一半空气的注射器。
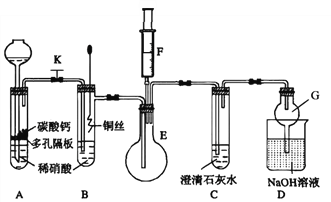
请回答有关问题:
①装置A中进行反应时打开止水夹K,当装置C中_________时,关闭止水夹K,试分析这样操作的目的是________,A中反应的离子方程式为______________。
②在完成①中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是__________________,B中反应的离子方程式为____________________。
③为进一步证明产物是NO,将注射器F中的空气推入E中,看到的现象是_________________。
④装置G的作用是_____________________。
(2)同学们发现铜与稀、浓硝酸反应所得溶液的颜色不同,并记录如下:
将1 g细铜丝放入盛有10 mL的1 mol·L-1 HNO3溶液的试管中加热 | 铜丝表面有无色气体逸出,溶液变为天蓝色 |
将1 g细铜丝放入盛有10 mL的14 mol·L-1HNO3溶液的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色 |
有同学认为是铜与浓硝酸反应的溶液中溶解了生成的气体,也有同学认为是溶液中剩余硝酸浓度较大所致,同学们分别设计了以下4个实验来判断该看法是否正确,以下方案中可行的是(选填序号字母)____________。
a. 向上述绿色溶液中通入氮气,观察颜色变化
b. 加水稀释上述绿色溶液,观察颜色变化
c. 向饱和的硝酸铜溶液中不断滴加14 mol·L-1HNO3溶液
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化