��Ŀ����
����Ŀ�������仯�������������������й㷺��Ӧ�ã�
��1����Ԫ����Ԫ�����ڱ��е�λ��Ϊ ��
��2�������ʵ��������ֱ������������ᡢˮ������һ�������·�Ӧ��������ͬ�����µ����������Ϊ �����ڸ�����������ˮ������Ӧ�Ļ�ѧ����ʽΪ ��
��3����ʽ������[Fe��OH��SO4]��һ��������ˮ����������Ч����������ҽҩ��Ҳ���������������������Ѫ����ҵ�����÷���м�����������������������ȣ�������ʽ�������Ĺ���������ͼ��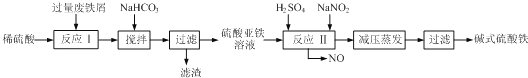
��֪�������£�����������������������ʽ����ʱ��Һ��pH���±���
������ | Fe3+ | Fe2+ | Al3+ |
��ʼ���� | 2.3 | 7.5 | 3.4 |
��ȫ���� | 3.2 | 9.7 | 4.4 |
�ټ�������NaHCO3��Ŀ���ǵ���pH��Ӧ����pH�ķ�ΧΪ ��
�ڼ�ʽ����������ˮ�������[Fe��OH��2+]���ӣ��ɲ���ˮ�����ɾۺ�����[Fe2��OH��42+]����ˮ�ⷴӦ�����ӷ���ʽΪ�� ��
��4��������أ�K2FeO4��Ҳ�dz��õ�ˮ�������������Ʊ������ж��֣�
�����ڷ��ֳ�Ϊ�������������������ڸ������ڵ��������Ʊ��������ƣ�Fe+3Na2O2=Na2FeO4+2Na2O���ٽ��������Ƽ��뵽����������Һ�������Ӧ��2KOH+Na2FeO4=K2FeO4+2NaOH������ݸ��ֽⷴӦԭ�������÷�Ӧ������ԭ�� ��
�ڵ�ⷨ�Ʊ�������أ�����ʯī�ֱ��������缫�ĵ缫���ϣ�����������Һ�����Һʵ�ֵ���Ʊ��������ĵ缫����Ϊ �� д�������ĵ缫��ӦʽΪ�� ��
���𰸡��������ڢ��壻3��4��3Fe+4H2O��g�� ![]() Fe3O4+4H2��4.4��7.5��2[Fe��OH��]2++2H2O?[Fe2��OH��4]2++2H+��K2FeO4�ܽ��С���������壬�ٽ���Ӧ���У�ʯī��Fe��6e��+8OH��=FeO42��+4H2O
Fe3O4+4H2��4.4��7.5��2[Fe��OH��]2++2H2O?[Fe2��OH��4]2++2H+��K2FeO4�ܽ��С���������壬�ٽ���Ӧ���У�ʯī��Fe��6e��+8OH��=FeO42��+4H2O
����������1������26��Ԫ�أ���Ԫ�����ڱ��е�λ��Ϊ�������ڢ��壬���Դ��ǣ��������ڢ��壻
��2����Fe�����ʵ���Ϊ1mol����
Fe+2HCl=FeCl2+H2��
1mol 1mol
3Fe+4H2O��g��![]() Fe3O4+4H2
Fe3O4+4H2
1mol ![]() mol��
mol��
��ͬ���������֮�ȵ������ʵ���֮�ȣ�������Ӧ�������������֮��Ϊ1mol��![]() mol=3��4�����Դ��ǣ�3��4��3Fe+4H2O��g��
mol=3��4�����Դ��ǣ�3��4��3Fe+4H2O��g�� ![]() Fe3O4+4H2��
Fe3O4+4H2��
��3�����Ʊ�����������Ӧ�����������룬Ӧ������ҺpH����Al��OH��3 �� Ҫ��������ӦFe��OH��2����������pH��4.4��7.5֮�䣬
���Դ��ǣ�4.4��7.5��
��[Fe��OH��]2+���ӣ��ɲ���ˮ������[Fe2��OH��4]2+�ۺ����ӣ����ݵ���غ�������غ��д����Ӧ�����ӷ���ʽΪ2[Fe��OH��]2++2H2O[Fe2��OH��4]2++2H+ ��
���Դ��ǣ�2[Fe��OH��]2++2H2O[Fe2��OH��4]2++2H+��
��4���ٸ��ֽⷴӦ�����������ɳ������������������ʣ���ΪK2FeO4�ܽ��С���������壬�ٽ���Ӧ���У����Դ��ǣ�K2FeO4�ܽ��С���������壬�ٽ���Ӧ���У���������������Ӧ������������������ʯī����ת��ΪFeO42�� �� ���Ե缫��ӦʽΪ��Fe��6e��+8OH��=FeO42��+4H2O�����Դ��ǣ�ʯī��Fe��6e��+8OH��=FeO42��+4H2O��

 ��У����ϵ�д�
��У����ϵ�д�