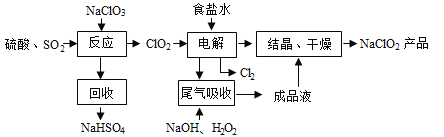
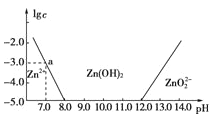
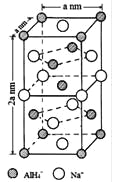
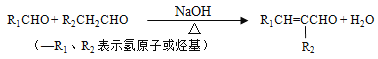
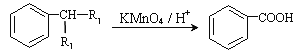题目内容
【题目】现有一瓶无色澄清的溶液,可能由以下离子中的几种组成:Na+、K+、NH4+、Fe2+、SO42-、I-、CO32-、Cl-、SO32-、MnO4-,请根据以下实验步骤及现象回答问题:
步骤一:取适量待测液,加入NaOH溶液并加热,得到溶液A,并产生刺激性气味的气体
步骤二:向溶液A加入足量稀盐酸和BaCl2溶液,得到溶液B、白色沉淀和有刺激性气味的气体
步骤三:往B溶液中通入适量Cl2,得到黄褐色溶液C
(1)下列有关该溶液说法正确的是__________。
A. 一定存在SO42-、I-、NH4+、SO32-
B. 一定不存在Fe2+、CO32-、MnO4-
C. 可能存在CO32-、Cl-、Na+、K+
D. 可用AgNO3溶液确认原溶液中是否存在Cl-
(2)步骤三得到黄褐色溶液的离子方程式是____________。
(3)若向原溶液中先加入足量的盐酸,再加入足量的________(填化学式)并加热,通过现象也能得出步骤一、二相同的结论。
(4)对于溶液中还可能存在的阳离子,确认其存在的实验方法是__________。
【答案】 A C Cl2+2I-=I2+2Cl- Ba(OH)2
焰色反应
【解析】本题分析:本题主要考查离子反应。无色溶液不含有紫色![]() 、淡绿色Fe2+。步骤一得到的刺激性气味的气体是氨气,表明原溶液含有
、淡绿色Fe2+。步骤一得到的刺激性气味的气体是氨气,表明原溶液含有![]() 。步骤二得到的白色沉淀是硫酸钡,有刺激性气味的气体是二氧化硫,表面原溶液含有
。步骤二得到的白色沉淀是硫酸钡,有刺激性气味的气体是二氧化硫,表面原溶液含有![]() 、
、![]() 。步骤三得到的黄褐色溶液C是含有I2的溶液,表明原溶液含有I-。
。步骤三得到的黄褐色溶液C是含有I2的溶液,表明原溶液含有I-。
(1)A. 正确。
B. 可能存在![]() 。
。
C. 可能存在CO32-、Cl-、Na+、K+ 。
D. ![]() 、
、![]() 、Cl-均可与AgNO3溶液反应生成白色沉淀,所以不能用AgNO3溶液确认原溶液中是否存在Cl-。
、Cl-均可与AgNO3溶液反应生成白色沉淀,所以不能用AgNO3溶液确认原溶液中是否存在Cl-。
(2)步骤三得到黄褐色溶液的反应是氯气置换碘的反应。
(3)向原溶液中加入足量盐酸, ![]() 与盐酸反应生成有刺激性气味的气体。再加入的物质既能与
与盐酸反应生成有刺激性气味的气体。再加入的物质既能与![]() 反应生成沉淀,又能与
反应生成沉淀,又能与![]() 反应生成氨气,所以是氢氧化钡。
反应生成氨气,所以是氢氧化钡。
(4)可通过焰色反应确定溶液中还可能存在的阳离子Na+、K+。

 53随堂测系列答案
53随堂测系列答案【题目】为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
![]()
(1)判断BaCl2已过量的方法是 。
(2)第④步中,相关的化学方程式是 。
(3)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解( ) |
B.天平的砝码已锈蚀( ) |
C.定容摇匀时,液面下降又加水( ) |
D.定容时俯视刻度线( ) |