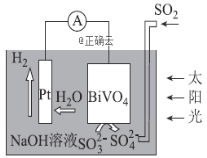
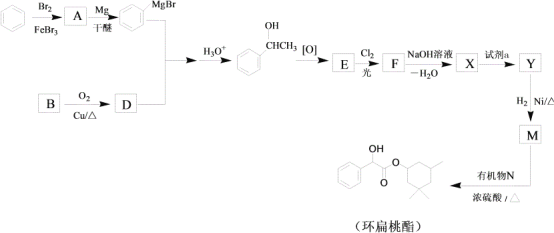
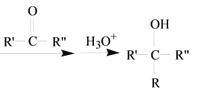
题目内容
【题目】11.2L甲烷、乙烷、甲醛组成的混合气体,完全燃烧后生成15.68L CO2(气体体积均在标准状况下测定),混合气体中乙烷的体积百分含量为( )
A.80%B.60%C.40%D.20%
【答案】C
【解析】
标准状况下,11.2L甲烷、乙烷、甲醛组成的混合气体的物质的量是11.2L÷22.4L/mol=0.5mol。燃烧后生成的CO2的物质的量是15.68L÷22.4L/mol=0.7mol,所以混合气组成中平均碳原子数为0.7÷0.5=![]() 。甲醛、甲烷分子中都含有一个碳原子,可以看做1个组分,即
。甲醛、甲烷分子中都含有一个碳原子,可以看做1个组分,即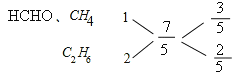
所以甲醛、甲烷的总物质的量与乙烷的物质的量之比为=3:2,体积分数等于物质的量分数,因此混合气体中乙烷的体积百分含量为![]()
答案选C。

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
【题目】已知293K时下列物质的溶度积![]() 单位已省略
单位已省略![]() :
:
| Ag2SO4 | FeS | CuS | Ag2S |
| 1.2×10-5 | 6.3×10-18 | 8.5×10-45 | 6.3×10-50 |
下列说法正确的是![]()
![]()
A.相同温度下,Ag2SO4、FeS、CuS饱和溶液中:![]()
B.向FeS悬浊液中滴加CuSO4溶液发生反应的离子方程式:![]()
C.浓度均为0.004mol/L的AgNO3和H2SO4溶液等体积混合后不能产生沉淀
D.向饱和Ag2S溶液中加少量Na2S固体,溶液中c(Ag+)不变