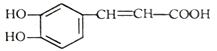
��Ŀ����
����Ŀ��������W��X��Y��Z��Q����Ԫ�ص�ԭ���������ε�����W��Zλ��ͬһ���塣��֪W���⻯�����Q�����ڹ��������·�Ӧ���ɶ��ֻ������Y��Q�γ�һ�ֹ��ۻ����X������������Ӧ��ˮ�������Z���ʷ�Ӧ���������Ļ�ԭ�����嵥��E������˵������ȷ���ǣ� ��
A. X��Z���������������ϣ����ɵIJ�������������
B. Y��Q�γɵĻ�������ǿ�����
C. W��X��Q����Ԫ�ض����γɶ���������
D. ���X��QԪ����ɵĻ�����ı�����Һ��������ʵ�����Ʊ�E����
���𰸡�D
��������
������W��X��Y��Z��Q����Ԫ�ص�ԭ���������ε�����W��Zλ��ͬһ���塣W���⻯�����Q�����ڹ��������·�Ӧ���ɶ��ֻ������W��CԪ�أ�Z��SiԪ�أ�Q��ClԪ�أ�Y��Q�γ�һ�ֹ��ۻ������Y��AlԪ�أ�X������������Ӧ��ˮ�������Z���ʷ�Ӧ���������Ļ�ԭ�����嵥��E����X��AlԪ�أ�E��H2��
����������֪W��CԪ�أ�X��NaԪ�أ�Y��AlԪ�أ�Z��SiԪ�أ�Q��ClԪ�ء�
A. X��Z�����������ֱ���NaOH��H2SiO3��ǰ����ǿ����������ᣬ���ᷢ������кͷ�Ӧ������Na2SiO3�������Ʋ���ȼ�գ�Ҳ��֧��ȼ�գ���˿������������A��ȷ��
B. Y��AlԪ�أ�Q��ClԪ�أ������γɵĻ�����AlCl3���Σ�����ǿ����ʣ�B��ȷ��
C.W��CԪ�أ����γ�������CO��CO2��X��NaԪ�أ����γ�������Na2O��Na2O2��Q��ClԪ�أ����γ�������Cl2O��ClO2��Cl2O7�ȣ���˶����γɶ��������C��ȷ��
D.X��Na��Q��Cl�����NaCl������Һ��������Ӧ��2NaCl+2H2O![]() Cl2��+H2��+2NaOH�����ڹ�ҵ��������NaOH��H2�����ںķѴ������ܣ����Բ�������ʵ������ȡH2����ʵ������ȡH2����Zn��ϡ���ᷴӦ��ȡ�ģ�D����
Cl2��+H2��+2NaOH�����ڹ�ҵ��������NaOH��H2�����ںķѴ������ܣ����Բ�������ʵ������ȡH2����ʵ������ȡH2����Zn��ϡ���ᷴӦ��ȡ�ģ�D����
�ʺ���ѡ����D��

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�����Ŀ�������������ᳫ����̼�������������Ƕ�Ӧ��ע��������⡣
(1)Ŀǰ��һЩ�����Ѹ�����Ȼ����CNG����ȼ�ϣ��Լ��ٶԿ�����Ⱦ��
��16g������ȫȼ������Һ̬ˮ�ų�890kJ�����������ȼ�յ��Ȼ�ѧ����ʽ��__________��
��1mol̼��ȫȼ�����ɶ�����̼����ų�393.5kJ������ͨ������Ƚϣ���д���б���ȷ��0.01����
��������1g | ȼ�շų�������/kJ | ����CO2������/g |
̼ | 32.80 | ____________ |
���� | ____________ | 2.75 |
���ݱ����е����ݣ���Ȼ����ú��ȣ�����Ȼ����ȼ�ϵ��ŵ���__________��
(2)Ϊ�˼��ٶ�����̼���ŷţ����ú���ɽ�������̼������ת����ˮ��һ�ֿ�����������ɫ��Դ�Ҵ����÷�Ӧ�Ļ�ѧ����ʽ��______________________________��
����Ŀ��I��������0.1mol��L-1�������pH=1�Ĵ����100mL�ֱ���������п����Ӧ������������ǰ�߱Ⱥ���_____(����������������������)��
II�����г�����pH��2��HCl��Һ��pH��2��CH3COOH��Һ�ң���������в����ش����⣺
(1)������0.1mol��L��1��CH3COOH��Һ��ˮϡ�����У����б���ʽ������һ����С����_____��
A��c��H+�� B��c��H+��/c��CH3COOH�� C��c��H+��c��OH-�� D��c��OH-��/c��H+��
(2)ȡ10mL������Һ������������ˮ��CH3COOH�ĵ���ƽ��________(��������������������������)�ƶ�����ȡ10mL������Һ������������ˮ�����ƹ���(����������ǰ����Һ������ֲ���)���������ܽ����Һ��c(H��)/c(CH3COOH)�ı�ֵ��________(��������������С��������ȷ����)��
(3)ȡ������ļס�������Һ���ֱ��õ�Ũ�ȵ�NaOHϡ��Һ�кͣ�������NaOH��Һ����Ĵ�С��ϵΪV(��)__ V(��) (����������������������)��
(4)��֪25��ʱ��������ĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.8��10��5 | K1��4.3��10��7 K2��4.7��10��11 | 3.0��10��8 |
�����������ӽ��H��������ǿ����________��
A��HCO3�� B��CO32�� C��ClO�� D��CH3COO��
д�����з�Ӧ�����ӷ���ʽ��HClO��Na2CO3(����)��______________________��
���������£�0.1 mol��L��l��KOH��Һ��10.00mL 0.10 mol��L��l H2C2O4 (��Ԫ���ᣩ��Һ�����õζ�������ͼ(�����Һ������ɿ��ɻ��ǰ��Һ�����֮��)����ش��������⣺

(1)�����ʾ��Һ���������ӵ�Ũ���ɴ�С��˳��Ϊ��_____________________��
(2)�����ʾ��Һ�У�c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)��________mol/L��
����Ŀ����(B)���γ�H3BO3��NaBH4��NaBO2�Ȼ������;�㷺��
(1)H3BO3ΪһԪ���ᣬ�����£���ˮ�д������µ���ƽ�⣺H3BO3 + H2O![]() [B(OH)4]-+H+��Ka=5.72��10-10��
[B(OH)4]-+H+��Ka=5.72��10-10��
��25��ʱ��0.175 mol/L��H3BO3��ҺpHԼΪ_________��
����֪̼��H2CO3�ĵ���ƽ�ⳣ��ΪKa1 = 4.4��10-7��Ka2 = 4.7��10-11��������̼������Һ�μӵ�����������Һ�У���Ӧ�����ӷ���ʽΪ_________��
(2)���ݻ��㶨Ϊ2 L���ܱ������м�������BPO4��Na���岢����һ������H2(g)�������ⷴӦ��BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) ��H��0
Na3PO4(s)+NaBH4(s) ��H��0
����ϵ��H2�����ʵ����뷴Ӧʱ��Ĺ�ϵ�����ʾ��
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
�����й�������ȷ����(����)_________��
a. �������������Ħ���������ٱ仯ʱ����Ӧ�ﵽƽ��״̬
b. 10 minʱ��������ͨ������H2�������´�ƽ��ǰ��(����)> ��(����)
c. �����¶Ȳ��䣬ƽ����ٳ���1 mol H2������ƽ��ʱH2��Ũ��Ϊ0.4 mol/L
d. �����¶ȣ��������ʼӿ죬���´ﵽƽ��ʱ����ѹǿ����
��ͼΪ�����뷴Ӧ�¶ȵĹ�ϵ���ߣ�NaBH4�IJ�����603K֮ǰ���¶����߶�������603K֮�����¶����߶���С��ԭ����_________��

(3)NaBH4(s)��H2O(l)����ˮ�⣬����������NaBO2(s)��

��ͨ��״���£�ʵ����3.8 g NaBH4(s)����ˮ�ⷴӦ�ų�21.6 kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ_________��
��![]() ΪNaBH4ˮ��İ�˥��(ˮ��һ������Ҫ��ʱ�䣬��λΪmin)��lg
ΪNaBH4ˮ��İ�˥��(ˮ��һ������Ҫ��ʱ�䣬��λΪmin)��lg![]() ��pH���¶ȵı仯��ͼ��ʾ����ҺpH=4ʱ��NaBH4_________(������������������)�ȶ����ڣ�ԭ����_________(�����ӷ���ʽ��ʾ)��T1_________T2��(�� ��>������<��)
��pH���¶ȵı仯��ͼ��ʾ����ҺpH=4ʱ��NaBH4_________(������������������)�ȶ����ڣ�ԭ����_________(�����ӷ���ʽ��ʾ)��T1_________T2��(�� ��>������<��)
�����⻯�ƾ��м�ǿ��ԭ�ԣ��������������ڴ�����Ʒ�Һ�е�CuSO4�Ƶ�����ͭ���Ӷ����Ϊ����д�����������Ӧ����ʽ_______________��
����Ŀ����ϩ����Ҫ�Ļ�������ԭ�ϣ�������Ϊԭ��������ϩ�ж��ַ�����
I.�����ѽ����ⷨ���÷����ķ�ӦΪ��C2H6(g)=C2H4(g)+H2(g) ��H=akJ/mol
(1)��֪101kPa��298Kʱ��C(s)��H2(g)����lmoC2H6(g)��1molC2H4(g)����H�ֱ�Ϊ��84.7 kJ/mol��+52.3kJ/mol����a=___________��
II.�����������ⷨ����ԭ�����м���������������������ķ�Ӧ���£�2C2H6(g)+O2(g)![]() 2C2H4(g)+2H2O(g) ��H<0������Ӧ��Ϊ���ȷ�Ӧ����������CH4(g)��CO(g)��CO2(g)��ԭ����(70.1%������29.9%C2H6)�ڷ�Ӧ����ͣ��15s���������������±���
2C2H4(g)+2H2O(g) ��H<0������Ӧ��Ϊ���ȷ�Ӧ����������CH4(g)��CO(g)��CO2(g)��ԭ����(70.1%������29.9%C2H6)�ڷ�Ӧ����ͣ��15s���������������±���
��Ӧ�¶�/�� | ����ת����/% | ��ϩѡ����/% | ����/% |
750 | 80.5 | 62.9 | 50.6 |
800 | 85.6 | 64.5 | 55.2 |
850 | 92.2 | 63.2 | 58.3 |
900 | 97.6 | 59.0 | 57.6 |
(2)�ٷ�Ӧ��ƽ�ⳣ������ʽΪK=___________��K(750��)___________K(900��)(����>������<������=��)
�ڵ��¶ȳ���800��ʱ����ϩ��ѡ���Խ��ͣ�����Ҫԭ�������________________��
III.���������ⷨ����Mo-V-Nb-Sb��������Ϊ�������ڳ�ѹ��380���£���Ӧ������������ѹ[P(O2)]�������ѹ[P(C2H6)�Ĺ�ϵ����ͼ��ʾ��

(3)��֪�÷�Ӧ�����ʷ���Ϊv=kPm(O2)��Pn(C2H6)����m=___________��n=___________��
IV����Ĥȼ�ϵ�ط���
(4)������������ϩ�����CO2�Ĵ����ŷţ������о���Ա������������������ϩ������Ĥȼ�ϵ��(SOFC)����ȼ�ϵ�صĸ�����ӦʽΪ__________�����ֵ�ع���������û��CO2�ŷţ�ԭ����______________��