��Ŀ����
(9��)
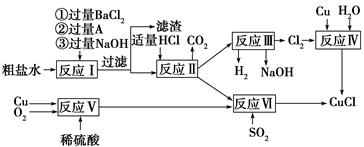
��FeCl3��Һʴ��ͭ�������·��Ĺ����У���Һ��������Դ���յĹ��̼������£�
I�����Һ��Ͷ�������м����ַ�Ӧ�������������Һ��
II������Һ�м���һ����ʯ��ˮ��������ҺpH��ͬʱ���������Ŀ�����
��֪��Ksp[Fe(OH)3]= 4.0��10-38
�ش��������⣺
(1)FeCl3ʴ��ͭ����Ӧ�����ӷ���ʽΪ ��
(2)����I ������м����Ҫ������ ������õ��������Ҫ�ɷ��� ���ӹ����з����ͭ����õķ����� ��
(3)����II�з�����Ӧ�Ļ�ѧ����ʽΪ ��
(4)����II�е�����Һ��pHΪ5����������Ũ��Ϊ ��(��ʽ����)
��FeCl3��Һʴ��ͭ�������·��Ĺ����У���Һ��������Դ���յĹ��̼������£�
I�����Һ��Ͷ�������м����ַ�Ӧ�������������Һ��
II������Һ�м���һ����ʯ��ˮ��������ҺpH��ͬʱ���������Ŀ�����
��֪��Ksp[Fe(OH)3]= 4.0��10-38
�ش��������⣺
(1)FeCl3ʴ��ͭ����Ӧ�����ӷ���ʽΪ ��
(2)����I ������м����Ҫ������ ������õ��������Ҫ�ɷ��� ���ӹ����з����ͭ����õķ����� ��
(3)����II�з�����Ӧ�Ļ�ѧ����ʽΪ ��
(4)����II�е�����Һ��pHΪ5����������Ũ��Ϊ ��(��ʽ����)
����1��2Fe3++Cu = 2Fe2++Cu2+����2������ͭ��Cu��Fe�������ᷴӦ����ˣ���3��FeCl2+Ca(OH)2 =Fe(OH)2��+CaCl2��4Fe(OH)2+O2+2H2O=4Fe(OH)3����4��c(Fe3+)=4.0��10-38��(10-9)3= 4.0��10-11 (mol/L)��
����1���Ȼ�����Һʴ��ͭ�巢�������ӷ���ʽΪ��2Fe3++Cu = 2Fe2++Cu2+����2������I�м�����м��Ϊ�˻���ͭ������õ��Ĺ����ǹ�������м�����ɵ�ͭ����������ͭʱ�����Լ����ᷴӦ����ˣ���3������II�У�����ʯ��ˮ�ķ�ӦΪ��FeCl2+Ca(OH)2 =Fe(OH)2��+CaCl2����������������������������4Fe(OH)2+ O2+ 2H2O= 4Fe(OH)3����4��������Һ��pHֵΪ5�����Ksp= c(Fe3+)��c(OH-)3��c(OH-)=Kw/c(H+)���ɵã�c(Fe3+)=4.0��10-38��(10-9)3= 4.0��10-11 (mol/L)��
(2)�������û���ͭ������������Ϊ����ͭ�Ļ����ٷ���ͭӦ�������(3)II������������������Fe(OH)2���������Ϊת����Fe(OH)3��(4)
�����㶨λ��������ͭ���ʴ��Ϊ���壬�ۺϿ��������ӷ���ʽ����д�����ʵķ��롢Ԫ�ػ��������ؼ���֪ʶ��
(2)�������û���ͭ������������Ϊ����ͭ�Ļ����ٷ���ͭӦ�������(3)II������������������Fe(OH)2���������Ϊת����Fe(OH)3��(4)
�����㶨λ��������ͭ���ʴ��Ϊ���壬�ۺϿ��������ӷ���ʽ����д�����ʵķ��롢Ԫ�ػ��������ؼ���֪ʶ��

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ
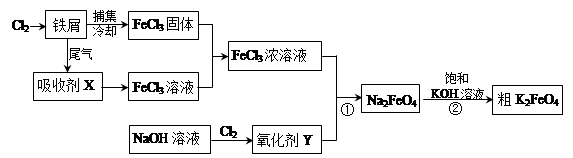
 4Fe(OH)3+8OH-+3O2�������ᴿK2FeO4ʱ�����ؽᾧ��ϴ�ӡ����º�ɵķ�������ϴ�Ӽ����ѡ�� ������ţ���
4Fe(OH)3+8OH-+3O2�������ᴿK2FeO4ʱ�����ؽᾧ��ϴ�ӡ����º�ɵķ�������ϴ�Ӽ����ѡ�� ������ţ��� CrO42-��Fe(OH)3����OH-
CrO42-��Fe(OH)3����OH-