题目内容
(13分)某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
(13分)
(1)2Fe2++H2O2+2H+=2Fe3++2H2O(2分) (2)C(2分)
(3)Fe(OH)3+3HF=FeF3+3H2O(2分) (4)通风橱(或密闭容器)(2分)
(5)FeF3+3Li=Fe+3LiF(2分) (6)Fe4O5(或2FeO?Fe2O3)(3分)
(1)2Fe2++H2O2+2H+=2Fe3++2H2O(2分) (2)C(2分)
(3)Fe(OH)3+3HF=FeF3+3H2O(2分) (4)通风橱(或密闭容器)(2分)
(5)FeF3+3Li=Fe+3LiF(2分) (6)Fe4O5(或2FeO?Fe2O3)(3分)
试题分析:(1)H2O2把Fe2+氧化为Fe3+,在酸性条件下的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)步骤②加入了过量的氢氟酸溶液,玻璃和陶瓷中含有二氧化硅,而二氧化硅能与氢氟酸反应,所以A、B项错误,故C项正确。
(3)沉淀为Fe(OH)3,加入氢氟酸发生酸碱中和反应,化学方程式为:Fe(OH)3+3HF=FeF3+3H2O
(4)反应过程中,挥发出腐蚀性气体HF,所以从安全的角度考虑,在实验室里制三氟化铁时应在通风橱(或密闭容器)中进行。
(5)Li的活泼性大于Fe,所以三氟化铁与Li发生置换反应的化学方程式为:FeF3+3Li=Fe+3LiF
(6)Cl2的物质的量为0.672L÷22.4L/mol=0.03mol,Cl2氧化Fe2+为Fe3+,根据电子转移守恒可知Fe2+的物质的量为0.03mol×2=0.06mol,故氧化物中+2价铁的物质的量为0.06mol,最后所得为氯化铁溶液,蒸干溶液,灼烧至恒重,得9.6g固体为Fe2O3,Fe2O3的物质的量为9.6g÷160g/mol=0.06mol,利用铁元素守恒可知氧化物中+3价铁的物质的量为0.06mol×2-0.06mol=0.06mol,所以铁氧体样品含Fe2O3的物质的量为:0.03mol,所以该铁氧体的化学式为Fe4O5(或2FeO?Fe2O3)

练习册系列答案
相关题目

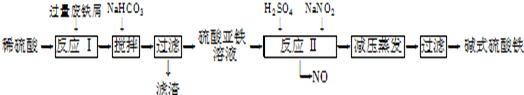
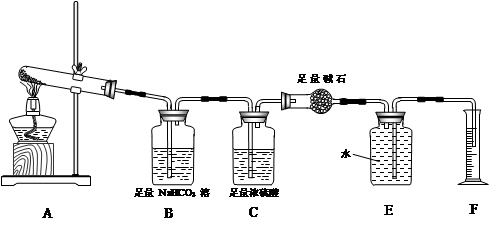 【实验过程】
【实验过程】