题目内容
小题1:EDTA是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
⑴画出EDTA二钠盐水溶液中浓度最高的阴离子的结构简式。
⑵ Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。写出这个排铅反应的化学方程式(用Pb2+ 表示铅)。
⑶能否用EDTA二钠盐溶液代替Ca(EDTA) 2-溶液排铅?为什么?
小题2:氨和三氧化硫反应得到一种晶体,熔点205oC,不含结晶水。晶体中的分子有一个三重旋转轴,有极性。画出这种分子的结构式,标出正负极。
小题3:Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。Na2[Fe(CN)5(NO)]是鉴定S2-的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。
小题4:CaSO4 ? 2H2O微溶于水,但在HNO3 ( 1 mol L?1)、HClO4 ( 1 mol L-1)中可溶。写出能够解释CaSO4在酸中溶解的反应方程式。
小题5:取质量相等的2份PbSO4 (难溶物)粉末,分别加入HNO3 ( 3 mol L-1) 和HClO4 ( 3 mol L-1),充分混合,PbSO4在HNO3 能全溶,而在HClO4中不能全溶。简要解释PbSO4在HNO3中溶解的原因。
小题6:X和Y在周期表中相邻。CaCO3与X的单质高温反应,生成化合物B和一种气态氧化物;B与Y的单质反应生成化合物C和X的单质;B水解生成D;C水解生成E,E水解生成尿素。确定B、C、D、E、X和Y。
小题1:⑴
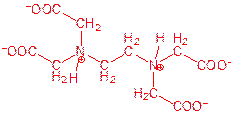
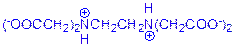 或
或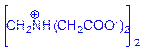 ,质子必须在氮原子上。
,质子必须在氮原子上。⑵ Pb2+ + Ca(EDTA) 2-= Ca 2+ + Pb (EDTA) 2-?
⑶不能。若直接用EDTA二钠盐溶液,EDTA阴离子不仅和Pb2+反应, 也和体内的Ca2+结合造成钙的流失。
小题2:
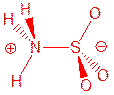
硫氧键画成双键或画成S→O,氮硫键画成N→S,均不影响。其他符合题设条件(有三重轴,有极性)的结构也可。
小题3:Fe(II),或II 或+2
[Fe(CN)5(NO)]2-+S2-= [Fe(CN)5(NOS)]4-
小题4:CaSO4 + H+ = Ca2+ + HSO4-
写成 2CaSO4 + 2HNO3 = Ca(NO3)2 + Ca(HSO4)2也可。高氯酸同。
小题5:Pb2+与NO3-形成络离子(配离子或配合物)。
写方程式也可,如PbSO4 + H+ + NO3- = HSO4- + Pb(NO3)+。若将络离子(配离子或配合物)写成Pb(NO3)2或Pb(NO3)3-也得分,但方程式须配平。
小题6:B: CaC2 C: CaCN2 D: C2H2 或Ca(OH) 2 E: NH2CN [C(NH)2也可] X: C Y: N
小题1:
⑴HY2-中存在碱性基团——氨基和酸性基团——羧基,因此在NaH2Y中,羧基失去质子,氨基中氮原子质子化。
⑵根据题意,Pb2+与EDTA2-形成稳定络合物,排出体外。
⑶若直接用EDTA二钠盐溶液,EDTA阴离子不仅和Pb2+反应, 也和体内的Ca2+结合造成钙的流失。
小题2:SO3是BF3的等电子体,与NH3发生简单加成反应。由于氮原子的电负性大于S原子的电负性,所以N原子带部分单位负电荷,S原子带部分单位正电荷。
小题3:由于μ=0,所以中心原子(Fe)不存在成单电子。由于Fe(Ⅲ)是d5结构,不论是内轨型,还是外轨型,都有成单电子,具有顺磁性,只有内轨型的Fe(Ⅱ)配位化合物没有成单电子,磁矩为零。
小题4:HNO3与HClO4都为强酸,电离出来的H+与SO42-结合生成较弱的电解质HSO4-,从而促使CaSO4(s)
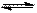 Ca2++SO42-向溶解的方向进行,而在水中,由于H+浓度小,酸效应不明显,因此在水中不溶。
Ca2++SO42-向溶解的方向进行,而在水中,由于H+浓度小,酸效应不明显,因此在水中不溶。小题5:PbSO4能溶于HNO3,但在HClO4不全溶,这说明NO3-与Pb2+能形成更稳定的配离子,使得[Pb2+]减小,从而s促进PbSO4完全溶解。(配位效应)
小题6:CaCO3在高温下与X的单质反应,这是高中典型化学反应,即生成CaC2的化学反应,根据B生成的最终产物分析,Y是N元素。根据原子守恒,C为CaCN2,水解产物为NH2CN,进一步水解生成尿素。

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
 (2)写出B、C 的最高价氧化物对应的水化物间反
(2)写出B、C 的最高价氧化物对应的水化物间反