题目内容
【题目】在我国南海、东海海底均存在大量的可燃冰(天然气水合物,可表示为![]() )。
)。
2017年5月,中国首次海域可燃冰试采成功。2017年11月3日,国务院正式批准将可燃冰列为新矿种。可燃冰的开采和利用,既有助于解决人类面临的能源危机,又能生成一系列的工业产品。
(1)对某可燃冰矿样进行定量分析,取一定量样品,释放出的甲烷气体体积折合成标准状况后为166 m3,剩余 H2O 的体积为0.8m3,则该样品的化学式中 x=_________________。
(2)已知下表数据,且知 H2O(l)=H2O(g) △H=+41![]()
化学键 | C—H | O=O | C=O | H—O |
键能/ | 413 | 498 | 803 | 463 |
用甲烷燃烧热表示的热化学方程式为_____________________________________________________。
(3)甲烷燃料电池相较于直接燃烧甲烷有着更高的能量转化效率,某甲烷燃料电池,正极通入空气,以某种金属氧化物为离子导体(金属离子空穴中能传导 O2-),该电池负极的电极反应式为__________________________________________。
(4)甲烷与水蒸气重整制氢是工业上获得氢气的重要手段。若甲烷与脱盐水在一定条件下反应生成H2,同时得到体积比为1:3的CO2和CO,该反应的化学方程式为_____________________________________。混合气体中的CO2可用浓氨水脱除,同时获得氮肥NH4HCO3,该反应的离子方程式是_________________________________________________________。
【答案】6 CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H= -892 kJ·mol-1 CH4-8e-+4O2-=CO2+2H2O ![]() NH3·H2O+CO2=NH4++
NH3·H2O+CO2=NH4++![]()
【解析】
(1)n(CH4)=![]() =
=![]() mol,n(H2O)=
mol,n(H2O)=![]() =
=![]() mol,n(CH4):n(H2O)=
mol,n(CH4):n(H2O)=![]() :
:![]() ≈1:6,所以x=6,故答案为:6;
≈1:6,所以x=6,故答案为:6;
(2) 由表格可知①CH4(g)+2O2(g)=CO2(g)+2H2O(g)的△H=(4×413+2×498-2×803×-4×463)kJ·mol-1= -810 kJ·mol-1,又因为②H2O(l)=H2O(g) △H=41![]() ,将①-2×②得:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=(-810-2×41)
,将①-2×②得:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=(-810-2×41)![]() = -892 kJ·mol-1,故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H= -892 kJ·mol-1;
= -892 kJ·mol-1,故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H= -892 kJ·mol-1;
(3)甲烷在负极失电子,被氧化,结合电解质、原子守恒、电荷守恒可得负极反应为:CH4-8e-+4O2-=CO2+2H2O,故答案为:CH4-8e-+4O2-=CO2+2H2O;
(4)由已知可知道,反应物为甲烷和水,生成物为氢H2、CO和CO2,结合CO2 和 CO的体积比为1:3可得方程式为:![]() 。二氧化碳和氨水反应生成NH4HCO3的离子方程式为:NH3·H2O+CO2=NH4++
。二氧化碳和氨水反应生成NH4HCO3的离子方程式为:NH3·H2O+CO2=NH4++![]() ,故答案为:
,故答案为:![]() ;NH3·H2O+CO2=NH4++
;NH3·H2O+CO2=NH4++![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
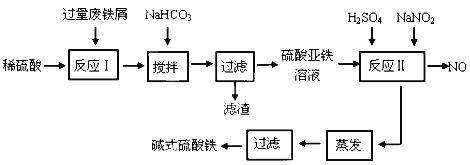
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
请回答下列问题:
(1)加入少量NaHCO3的目的是调节pH范围在__________________________内,使溶液中的___________________沉淀(写离子符号),该反应的离子方程式为_________________________________ 。
(2)反应Ⅱ中的离子方程式为________________________________________________ 。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为_____________________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为___________________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为___________________。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
【题目】目前我国主要采用硫酸法生产钛白(TiO2),每年产生至少100万吨钛白废液,其中含H2SO4约20%,还有少量Fe2+、TiO2+、Al3+。利用钛白废液浸出氧化锌生产七水硫酸锌,具有原料易得、工艺简单、回收率高和产品纯度高等优点。生产流程简化如下:

回答下列问题:
(1)“浸出”时发生的主要反应的离子方程式为_______。
(2)为寻找“浸出”的最佳条件,做9组对比实验得下表:
因素 | 温度/℃ | 反应时间/h | 固液比 | 产率/% |
1 | 70 | 2 | 1∶6.5 | 79.83 |
2 | 70 | 3 | 1∶7.5 | 86.18 |
3 | 70 | 4 | 1∶8.5 | 84.33 |
4 | 80 | 2 | 1∶7.5 | 83.06 |
5 | 80 | 3 | 1∶8.5 | 87.02 |
6 | 80 | 4 | 1∶6.5 | 95.38 |
7 | 90 | 2 | 1∶8.5 | 83.58 |
8 | 90 | 3 | 1∶6.5 | 88.95 |
9 | 90 | 4 | 1∶7.5 | 89.64 |
由表中数据可知,“浸出率”最高时的反应条件是_______。
(3)从生产实际考虑,调滤液的pH时选择加入石灰乳的原因是_______。
(4)常温下,按1:6固液质量比反应的浸出液中锌离子浓度最大值约为2.5mol/L,若Ksp[Zn(OH)2]=1.2×10-17,lg4.8≈0.68。则加入石灰乳调节的pH应不超过______(保留一位小数)。
(5)在加热下鼔入空气时,发生反应的化学方程式是___,此时TiO2+也会水解生成H2TiO3沉淀,发生反应的离子方程式为_____。
(6)加热下加入H2O2目的是进一步氧化除杂,氧化产物为__。抽滤得到的滤渣主要成分有___和H2TiO3(填化学式)。



