��Ŀ����
����Ŀ����ͼ��ʾ����A��B�ж�����2molX��2molY����ʼVA=0.8a L��VB=a L�����¶Ȳ��䣬���д����������£��������и��Է������з�Ӧ��X(g)+Y(g)![]() 2Z(g)+W(g)�ﵽƽ��ʱ��VA=0.9a L��������˵��������� ( )
2Z(g)+W(g)�ﵽƽ��ʱ��VA=0.9a L��������˵��������� ( )
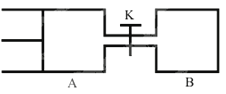
A. �������дﵽƽ���ʱ��A<B
B. ��K�ﵽ��ƽ�������B�����¶�,A����������ԭƽ��״̬ʱһ������
C. A������X��ת����Ϊ25%���ұ�B�����е�X��ת����С
D. ��Kһ��ʱ���ƽ��ʱ��A�����Ϊ0.8a L����ͨ���е�����������ƣ�
���𰸡�C
��������
����ͼ��֪,A���ֺ�ѹ,B���ֺ�����A����ѧ��Ӧ���������ʵ�Ũ���й�,Ũ��Խ��,��Ӧ����Խ��; B����K����ƽ���ЧΪA�е����ƽ��,����X��ת���ʼ���ƽ����ܵ����ʵ���,�ٸ������֮�ȵ������ʵ���֮�ȼ��������,��������A���������,�����¶�,ƽ�������ȷ����ƶ�,�ݴ��ж�;C���ȸ�����ͬ������,���������֮�ȵ������ʵ���֮�ȼ���ƽ�����������ʵ���,�ٽ�Ϸ���ʽ����X��Ӧ�����ʵ���,������ת���ʹ�ʽ����X��ת����,�ٽ��Bװ����ѹǿ�Ի�ѧƽ���Ӱ���ж�X��ת����;D�������¶�,ƽ�������ȷ����ƶ�;�����¶�,��������,�������;
A����ʼʱVA=0.8a L��VB=a L,Aװ���е�Ũ�ȴ���Bװ���е�Ũ��,�����ŷ�Ӧ�Ľ���,������ȻAװ���е�Ũ�ȴ���Bװ���е�Ũ��,�����������дﵽƽ���ʱ��A<B,����A��ȷ; B����ӦX(g)+Y(g)![]() 2Z(g)+W(g)
2Z(g)+W(g)![]() H<0,���������¶�,ƽ�����淴Ӧ�����ƶ�,�������¶�,��������,�������,������A�����������������,Ҳ���ܼ�С,��B����;C���ﵽƽ��ʱ, VA=0.9a L,��ѹ������������,��������֮�ȵ�����������ʵ���֮��,����ƽ�������������ʵ�����4mol/0.8
H<0,���������¶�,ƽ�����淴Ӧ�����ƶ�,�������¶�,��������,�������,������A�����������������,Ҳ���ܼ�С,��B����;C���ﵽƽ��ʱ, VA=0.9a L,��ѹ������������,��������֮�ȵ�����������ʵ���֮��,����ƽ�������������ʵ�����4mol/0.8![]() 0.9=4.5mol,
0.9=4.5mol,
��μӷ�Ӧ��A�����ʵ���Ϊmmol,��:
X(g)+Y(g)![]() 2Z(g)+ W(g)
2Z(g)+ W(g)
��ʼ��mol�� 2 2 0 0
��Ӧ��mol�� m m 2m m
ƽ����mol�� 2-m 2-m2m m
��2-m+2-m+2m+m=4.5m,����ó�m=0.5,����X���ʵ�ת����=0.5/2![]() 100%=25%;Bװ�����ں���������,��Ӧ������Ӧ�����ƶ�ʱ,�����������ʵ�������,��������������ѹǿ����,����ѹǿ������X��ת����,��A��B������X��ת����С,����C��ȷ;D����K����ƽ���ЧΪA�е����ƽ��,X��ת����Ϊ25%,�μӷ�Ӧ��X���ܵ����ʵ���Ϊ4mol
100%=25%;Bװ�����ں���������,��Ӧ������Ӧ�����ƶ�ʱ,�����������ʵ�������,��������������ѹǿ����,����ѹǿ������X��ת����,��A��B������X��ת����С,����C��ȷ;D����K����ƽ���ЧΪA�е����ƽ��,X��ת����Ϊ25%,�μӷ�Ӧ��X���ܵ����ʵ���Ϊ4mol![]() 25%=1mol��
25%=1mol��
X(g) + Y(g)![]() 2Z(g)+ W(g)
2Z(g)+ W(g)
��ʼ��mol��4 4 0 0
��Ӧ��mol��1 1 2 1
ƽ����mol��3 3 2 1
��ƽ����������ܵ����ʵ���Ϊ3+3+2+1=9mol,��������֮�ȵ�����������ʵ���֮��,�������������Ϊ0.8a/4mol![]() 9mol=1.8aL,��VA=1.8aL- aL =0.8 aL,����Dѡ������ȷ��;�𰸣�B
9mol=1.8aL,��VA=1.8aL- aL =0.8 aL,����Dѡ������ȷ��;�𰸣�B

����Ŀ���״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ�Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ | ƽ�ⳣ�� | �¶ȣ��棩 | |
500 | 800 | ||
��2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
��H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
��3H2(g)+ CO2(g) | K3 | ||
��1����Ӧ����_________������ȡ����ȡ�����Ӧ��
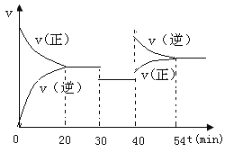
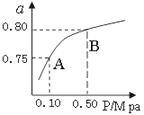
��2��ij�¶��·�Ӧ����H2��ƽ��ת���ʣ�a������ϵ��ѹǿ(P)�Ĺ�ϵ����ͼ1��ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K(A)_____K(B)�����������������������
ͼ 1 ͼ2
��3���жϷ�Ӧ�ۡ�H____0�� ��S____0���>����=����<������500�桢2L���ܱ������У����з�Ӧ�ۣ����ijʱ��H2��CO2�� CH3OH��H2O�����ʵ����ֱ�Ϊ6mol��2 mol��10 mol��10 mol�� ��ʱv(��)___v(��)���>����=����<����
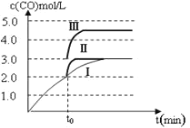
��4��һ���¶��£���3 L�ݻ��ɱ���ܱ������з�����Ӧ�ڣ���֪ c(CO)�뷴Ӧʱ��t�仯���ߢ�����ͼ2��ʾ������t0ʱ�̷ֱ�ı�һ�����������ߢ��Ϊ���ߢ�����ߢ����ߢ��Ϊ���ߢ�ʱ���ı��������________�������ߢ��Ϊ���ߢ�ʱ���ı��������_____________��
��5��һ�������¼״���һ����̼��Ӧ���Ժϳ����ᣮ���������£���amol/L��CH3COOH��bmol/LBa��OH��2��Һ�������ϣ���Ӧƽ��ʱ��2c��Ba2+��=c��CH3COO-�����ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��Ϊ________��