题目内容
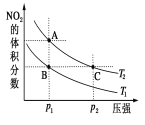
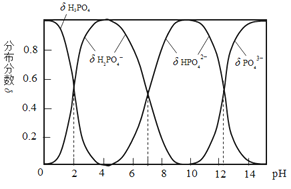
【题目】磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如图,下列说法正确的是( )
A.H3PO4的电离方程式为:H3PO4![]() 3H++ PO43
3H++ PO43
B.pH=2时,溶液中大量存在的微粒有:H3PO4、H2PO4、HPO42、PO43
C.滴加NaOH溶液至pH=7,溶液中c(Na+)= c(H2PO4)+2c(HPO42)+3c(PO43)
D.滴加少量Na2CO3溶液,3Na2CO3+2H3PO4 =2Na3PO4+3H2O+3CO2↑
【答案】C
【解析】
观察图可知:随着PH值的增大,水溶液中各种含磷微粒的含量相应的发生改变:PH从0到4,H3PO4含量下降,H2PO4-含量上升,PH=2时,两者浓度相等,其它含磷微粒含量几乎为零;从4到10,H2PO4-含量下降,HPO42-含量上升,PH=7时,两者浓度相等,其它含磷微粒含量几乎为零;pH>10,HPO42-含量下降,PO43-含量上升,PH在虚线所标处两者浓度相等,其它含磷微粒含量几乎为零。根据图中各微粒的分布情况,结合弱电解质的电离,电中性原则及物质的基本性质可对各选项作出判断。
A项、磷酸是三元中强酸,属于弱电解质,电离方程式应分步书写,A选项错误;
B项、由图可知,PH=2时,含磷微粒主要是H3PO4和H2PO4-,其它含量几乎为零,B错;
C项、根据电中性原则有:c(H+)+c(Na+)= c(H2PO4)+2c(HPO42)+3c(PO43)+c(OH-),PH=7时,c(H+)=C(OH-),所以有:c(Na+)= c(H2PO4)+2c(HPO42)+3c(PO43),C正确;
D项、生成二氧化碳的环境为酸性环境,在磷酸中滴加少量碳酸钠溶液得到的含磷产物主要是H2PO4-或HPO42-,D错;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】对下列叙述的评价合理的是
选项 | 叙述 | 评价 |
A | 乙酸乙酯在H | 对,根据酯的水解规律,产物乙醇中将含有18O同位素,而乙酸则没有 |
B | 明矾和漂白粉都可用于水的净化 | 对,二者的作用原理相同 |
C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | 对,K2CO3与NH4Cl反应生成氨气会降低肥效 |
D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇、乙酸和葡萄糖 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇和乙酸 |
A.AB.BC.CD.D
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D