题目内容
【题目】(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:
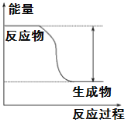
①该反应为________反应(填“吸热”或“放热”)。
②若要使该反应的反应速率加快,下列措施可行的是________(填字母)。
A.改稀硫酸为98%的浓硫酸 B.升高温度 C.改铁片为铁粉
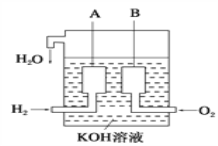
(2)美国阿波罗宇宙飞船上使用了一种新型燃料电池,其构造如图所示,A、B两个电极均由多孔的碳块组成,该电池的负极反应式为:_______________________________。
(3)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。回答下列问题:
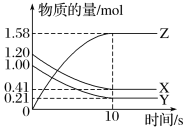
①从反应开始到10 s时,v(Z)=______________。
②反应的化学方程式为______________________________________。
【答案】放热 B C H2-2e-+2OH-=2 H2O 0.079 mol·L-1·s-1 X(g)+Y(g) 2Z(g)
【解析】
(1)①从图象可知,反应物总能量高于生成物总能量;
②改变固体表面积、升高温度加快反应速率;常温下铁在浓硫酸中钝化;
(2)该装置是甲烷燃料碱性电池,通入甲烷的电极a是负极,则b是正极,负极上电极反应式为 CH4-8e-+10OH-=CO32-+7H2O,正极上电极反应式为O2+2H2O+4e-=4OH-,原电池放电时,电流从正极沿导线流向负极,电解质溶液中阳离子向正极移动、阴离子向负极移动;
(3)①从图象可知生成Z的物质的量,由物质的量计算物质的量浓度的变化量,再计算化学反应速率;
②从图象可知反应物和生成物,由各物质的变化量之比的化学方程式计量数之比,由此写出化学方程式。
(1)①从图象可知,反应物总能量高于生成物总能量,所以该反应为放热反应,故答案为:放热;
②A、常温下铁在浓硫酸中钝化不能继续发生反应,错误;
B、改铁片为铁粉,增大了接触面积,反应速率增大,正确;
C、升高温度,反应速率增大,正确;
故选BC,故答案为:BC;
(2)该装置是甲烷燃料碱性电池,通入甲烷的电极a是负极,则b是正极,负极上甲烷放电生成碳酸根,电极反应式为 CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=
CO32-+7H2O;
(3)①由图像可知,反应生成Z的物质的量为1.58mol,Z的浓度变化量为1.58mol/2L=0.79mol/L,则从反应开始到10 s时,v(Z)为0.79mol/L/10 s=0.079 mol·L-1·s-1,故答案为:0.079 mol·L-1·s-1;
②由图可知,各物质的变化量为:X为0.79 mol,Y为0.79 mol,Z为1.58 mol,由变化量之比等于化学计量数之比可知,化学方程式中各物质的化学计量数之比为1∶1∶2,则化学方程式为X(g)+Y(g) 2Z(g),故答案为:X(g)+Y(g)2Z(g)。