题目内容
【题目】足量铜溶于一定量浓硝酸,产生NO2、N2O4、NO的混合气体,这些气体若与1.12 L O2(标准状况)混合后通入水中,气体被水完全吸收。若向原所得溶液中加入5 mol·L-1 H2SO4溶液100 mL,则继续溶解的Cu的质量为( )
A. 6.4 g B. 9.6 g C. 19.2 g D. 24 g
【答案】C
【解析】试题分析:Cu和浓硝酸反应过程中,Cu失电子生成铜离子、硝酸得电子生成NO2、N2O4、NO,且转移电子守恒,这些气体若与1.12LO2(标况)混合后通入水中,气体被完全吸收,说明氧气得到的电子等于这些气体生成硝酸根离子得到的电子,所以氧气得到的电子等于Cu失去的电子,根据转移电子得n(Cu)=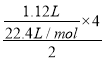 =0.1mol,根据原子守恒得n(Cu)=n[Cu(NO3)2]=0.1mol,再加入稀硫酸后,相当于溶液中含有硝酸,能继续溶解Cu,n(H+)=2n(H2SO4)=2×5mol/L×0.1L=1mol,n(H+):n(NO3-)=1mol:0.2mol=5:1>1/4,所以氢离子有剩余,根据硝酸根离子计算溶解铜的质量,设溶解Cu的质量为x,则
=0.1mol,根据原子守恒得n(Cu)=n[Cu(NO3)2]=0.1mol,再加入稀硫酸后,相当于溶液中含有硝酸,能继续溶解Cu,n(H+)=2n(H2SO4)=2×5mol/L×0.1L=1mol,n(H+):n(NO3-)=1mol:0.2mol=5:1>1/4,所以氢离子有剩余,根据硝酸根离子计算溶解铜的质量,设溶解Cu的质量为x,则
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
192g 2mol
x 0.2mol
192g:2mol=x:0.2mol
解得x=19.2g,答案选C。

【题目】氯化铁在现代生产和生活中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做了如下探究实验。

已知:Ⅰ.无水氯化铁在空气中易潮解,加热易升华;
Ⅱ.工业上,向500~600℃的铁屑中通入氯气可生产无水氯化铁;
Ⅲ.向炽热铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。
请回答下列问题:
(1)装置的连接顺序为 _____________(按气流从左向右的方向,填仪器接口字母)。
(2)装置D的作用是 _________;
若缺少装置E对本实验造成的影响是_________________________________________。
(3)工业生产中,会将装置D中的干燥剂换成无水氯化钙,通过装置D后产生的过量氯气再用氯化亚铁溶液吸收,得到氯化铁溶液作为副产品。氯化亚铁溶液因吸收Cl2失去作用而失效,下列试剂中能够检验氯化亚铁溶液是否完全失效的所用的试剂是_____________。
(4)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验: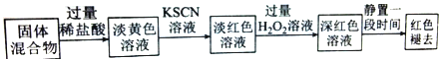
淡红色溶液中加入过量H2O2后溶液红色加深的原因是 __________ (用离子方程式表示)。
实验 | 操作 | 现象 | |
实验甲:取褪色后溶液3等份 | 第1份 | 滴加FeCl3溶液 | 无明显变化 |
第2份 | 滴加KSCN溶液 | 溶液变为红色 | |
第3份 | 滴加稀盐酸和BaCl2 | 产生白色沉淀 | |
实验乙:取与褪色后溶液同浓度的FeCl3溶液 | 滴加2滴KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
根据实验现象判断,以下说法不正确的是 _____(填选项字母)。
A. 实验甲说明是Fe3+发生了反应而不是SCN—发生反应
B. 实验甲说明是SCN—发生了反应而不是Fe3+发生反应
C.实验甲中第3份溶液中生成的白色沉淀为BaSO4
D.实验乙排除H2O2分解产生的O2氧化SCN—的可能
由实验甲和乙得出的结论为______________________________ 。