题目内容
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38oC时析出的晶体是NaClO2·3H2O,高于38oC时析出晶体是NaClO2,高于60oC时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。装置②反应容器为三颈烧瓶。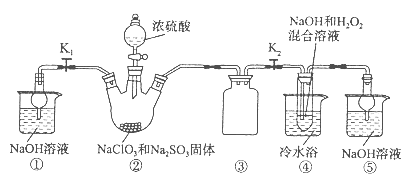
完成下列填空:
(1)组装好仪器后,检查整套装置气密性的操作是: 。
(2)装置②中产生ClO2的化学方程式为 。
装置④中发生反应的离子方程式为 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55oC蒸发结晶;② ;③ ;④低于60oC干燥,得到成品。
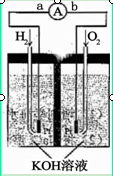
(4)目前已开发出用电解法制取ClO2的新工艺。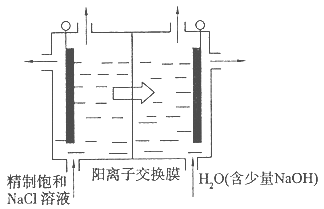
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生C1O2的电极反应为 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为 mol。
(5)准确称取所得亚氯酸钠样品l0 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+4I-+4H+=2H2O+2I2+C1-)。将所得混合液配成250 mL待测溶液。配制待测液需用到的定量玻璃仪器是 ;取25.00 mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为 。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为 。
(1)关闭分液漏斗活塞,打开K1、K2,向①⑤中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若①、⑤处有气泡产生,停止加热,一段时间后,①、⑤干燥管内形成一段稳定水注,说明整套装置气密性良好。(其他合理答案均得分)
(2)2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2ClO2+H2O2+2OH—=2ClO2—+2H2O+O2↑;
(3)趁热过滤;用38℃~60℃温水洗涤;
(4)Cl--5e-+2H2O=ClO2↑+4H+;0.01mol;
(5)溶液由蓝色变为无色且半分钟内不变色;90.5%。
解析试题分析:(1)组装好仪器后,检查整套装置气密性的操作是:关闭分液漏斗活塞,打开K1、K2,向①⑤中加水没过干燥管下端,用酒精灯微热三颈烧瓶,若①、⑤处有气泡产生,停止加热,一段时间后,①、⑤干燥管内形成一段稳定水注,说明整套装置气密性良好。(其他合理答案均得分)(2)装置②中产生ClO2的反应是氯酸钠、亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化氯和水,化学方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;根据题意知,装置④反应后获得NaClO2晶体,即ClO2、NaOH和H2O2反应生成NaClO2、H2O和O2,离子方程式为2ClO2+H2O2+2OH—=2ClO2—+2H2O+O2↑;(3)从溶液中得晶体一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2?3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,答案为:趁热过滤;用38℃~60℃温水洗涤;(4)①根据题给装置分析,电解池阳极反应为氯离子失电子生成ClO2,氯元素的化合价由—1价升高到+5价,结合原子守恒和电荷守恒写出,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+②电解池阴极为氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,氢气的物质的量为0.005mol,则放电的氢离子为0.01mol,根据电中性原则通过阳离子交换膜的阳离子为+1价离子的物质的量为0.01mol;(5)根据题意知,配制250mL待测液需用到的定量玻璃仪器是250mL容量瓶;以淀粉溶液做指示剂,碘单质遇淀粉变蓝色,反应结束时,碘反应完全,蓝色褪去,达到滴定终点时的现象为当滴加最后一滴Na2S2O3标准液时,溶液由蓝色变为无色且半分钟内不变色;根据题给反应ClO2-+4I-+4H+=2H2O+2I2+C1-,I2+2S2O32-=2I-+S4O62-得关系式:NaClO2——4S2O32-,设样品中NaClO2的质量分数为x,则有:
NaClO2——4S2O32-
90.5g 4mol
10xg 2 mol?L-1×0.02L×10
解得x=90.5%。
考点:考查化学实验基本操作、离子方程式的书写、电化学原理及关系式法计算。

 期末集结号系列答案
期末集结号系列答案ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是______________________________________________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式_____________________________。
(2)乙中负极为________,总反应的离子方程式:
______________________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强。(填写元素符号)
(4)由此实验得出的下列结论中,正确的有________。
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:


(1)M为直流电源的________极,b电极上发生的电极反应为________。
(2)计算e电极上生成的气体在标准状况下的体积为________________。
(3)写出乙烧杯中的总反应的离子方程式:_________________________________。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量)______________________________。



 CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
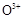 ,然后以C
,然后以C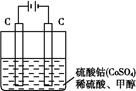
 2LiH
2LiH