题目内容
3. 某溶液含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(写出最佳答案):
某溶液含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(写出最佳答案):(1)所加试剂的化学式:AHCl、CNaOH
(2)生成沉淀3的离子方程式Cu2++2OH-=Cu(OH)2↓.
分析 溶液含有Ba2+、Cu2+、Ag+,应先加入HCl,生成AgCl沉淀,过滤后在加入Na2SO4,可得到BaSO4沉淀,最后加入NaOH,可得到Cu(OH)2沉淀,以此解答该题.
解答 解:(1)溶液含有Ba2+、Cu2+、Ag+,应先加入A(HCl),生成AgCl沉淀,过滤后在加入Na2SO4,可得到BaSO4沉淀,最后加入NaOH(C),可得到Cu(OH)2沉淀,
故答案为:HCl;NaOH;
(2)最后加入NaOH,可得到Cu(OH)2沉淀,即沉淀3,反应的离子方程式为Cu2++2OH-=Cu(OH)2↓,故答案为:Cu2++2OH-=Cu(OH)2↓.
点评 本题考查物质的分离、提纯,为高频考点,题中侧重学生的分析、实验能力的考查,涉及离子方程式的书写,题目难度中等,注意使离子逐一沉淀应先加入HCl,不能先加入NaOH,否则不能达到逐一沉淀的目的.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
13.下列反应中,属于氧化还原反应的是( )
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | CaO+H2O═Ca(OH)2 | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | H2CO3═H2O+CO2↑ |
14.下列变化需要加入还原剂才能实现的是( )
| A. | NH3→NH4+ | B. | Fe2+→Fe | C. | H2S→SO2 | D. | Cl-→Cl2 |
18.一定温度下,将2molA、2molB、2molC的气体混合物充入一体积不变密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大了20%,则容器中可能发生的反应是( )
| A. | 2A+B?2C | B. | A+B?2C | C. | 2A+B?C | D. | 2A+B?4C |
8.利用右图所示装置进行下列实验,不能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 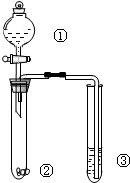 |
| A | 浓盐酸 | KMnO4 | NaBr溶液 | 氧化性:KMnO4>Cl2>Br2 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
| D | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硫酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
15.设NA是阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1molAl3+离子含有的电子数为3NA | |
| B. | 1molCl2含有1NA个原子 | |
| C. | 58.5g氯化钠固体中,含1NA个阴离子 | |
| D. | 欲配制1.00L 1.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
12. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).
(1)判断反应达到平衡状态的依据是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K=$\frac{c(CH{\;}_{3}OH)}{c(CO)c{\;}^{2}(H{\;}_{2})}$,△H<0(填“>”、“<”或“=”).
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
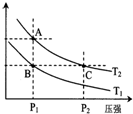
(3)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-akJ•mol-1;②2CO(g)+O2(g)═2CO2(g)△H=-bkJ•mol-1;③H2O(g)═H2O(l)△H=-ckJ•mol-1.写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1.
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).(1)判断反应达到平衡状态的依据是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(3)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-akJ•mol-1;②2CO(g)+O2(g)═2CO2(g)△H=-bkJ•mol-1;③H2O(g)═H2O(l)△H=-ckJ•mol-1.写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1.
13.下列与化学概念有关的说法正确的是( )
| A. | SiO2、P2O5、NO均为酸性氧化物 | |
| B. | NaH、NaBH4、NaClO均为离子化合物 | |
| C. | NH3.H2O是弱碱,所以NH4NO3为弱电解质 | |
| D. | 磁性氧化铁、水玻璃、液氨均为混合物 |