题目内容
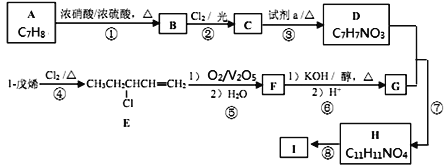
【题目】功能高分子I的一种合成路线如下,其中D能与Na反应生成H2,且D苯环上的一氯代物有2种。
已知:![]()
回答下列问题:
(1)A的名称为________,试剂a为________________。
(2)C的结构简式为________________________。
(3)F中的官能团名称为________。
(4)上述①—⑧的反应中,不属于取代反应的是________(填数字编号)。写出反应⑦的化学方程式________________________________________。
(5)符合下列条件的B的同分异构体有________种。
①苯环上有氨基(—NH2) ②能发生银镜反应
其中核磁共振氢谱有4组峰,且峰面积比为2∶2∶2∶1的结构简式为__________。
(6)参照上述合成路线,以1-丁烯为原料(无机试剂任选),设计制备丙烯酸(CH2=CHCOOH)的合成路线________________________________________。
【答案】甲苯 NaOH 水溶液 ![]() 氯原子 羧基 ⑤⑥⑧
氯原子 羧基 ⑤⑥⑧ ![]() 13
13 ![]()
![]()
【解析】
D能与Na反应生成H2,且D苯环上的一氯代物有2种,则两个取代基在对位上。故B、C的取代基也在对位,由此推出A为甲苯,甲苯在浓硫酸催化下与浓硝酸反应生成B为对硝基甲苯,对硝基甲苯在光照条件下与氯气发生取代反应生成C为![]() ;
;![]() 在氢氧化钠溶液中加热发生取代反应,生成D为
在氢氧化钠溶液中加热发生取代反应,生成D为![]() ;根据已知:
;根据已知:![]() ,CH3CH2CHClCH=CH2反应生成CH3CH2CHClCOOH和甲酸,则F为CH3CH2CHClCOOH,CH3CH2CHClCOOH在氢氧化钾的醇溶液中发生消去反应,以及酸性强的制取酸性弱的,生成G为HOOC-CH=CH-CH3;HOOC-CH=CH-CH3与
,CH3CH2CHClCH=CH2反应生成CH3CH2CHClCOOH和甲酸,则F为CH3CH2CHClCOOH,CH3CH2CHClCOOH在氢氧化钾的醇溶液中发生消去反应,以及酸性强的制取酸性弱的,生成G为HOOC-CH=CH-CH3;HOOC-CH=CH-CH3与![]() 发生酯化反应生成
发生酯化反应生成![]() 和水;则H为
和水;则H为![]() ;
;![]() 发生加聚反应生成功能高分子I;
发生加聚反应生成功能高分子I;
D能与Na反应生成H2,且D苯环上的一氯代物有2种,则两个取代基在对位上。故B、C的取代基也在对位,由此推出A为甲苯,甲苯在浓硫酸催化下与浓硝酸反应生成B为对硝基甲苯,对硝基甲苯在光照条件下与氯气发生取代反应生成C为![]() ;
;![]() 在氢氧化钠溶液中加热发生取代反应,生成D为
在氢氧化钠溶液中加热发生取代反应,生成D为![]() ;根据已知:
;根据已知:![]() ,CH3CH2CHClCH=CH2反应生成CH3CH2CHClCOOH和甲酸,则F为CH3CH2CHClCOOH,CH3CH2CHClCOOH在氢氧化钾的醇溶液中发生消去反应,以及酸性强的制取酸性弱的,生成G为HOOC-CH=CH-CH3;HOOC-CH=CH-CH3与
,CH3CH2CHClCH=CH2反应生成CH3CH2CHClCOOH和甲酸,则F为CH3CH2CHClCOOH,CH3CH2CHClCOOH在氢氧化钾的醇溶液中发生消去反应,以及酸性强的制取酸性弱的,生成G为HOOC-CH=CH-CH3;HOOC-CH=CH-CH3与![]() 发生酯化反应生成
发生酯化反应生成![]() 和水;则H为
和水;则H为![]() ;
;![]() 发生加聚反应生成功能高分子I;
发生加聚反应生成功能高分子I;
(1)A的名称为甲苯,![]() 在氢氧化钠溶液中加热发生反应生成
在氢氧化钠溶液中加热发生反应生成![]() ,故试剂a为NaOH 水溶液;
,故试剂a为NaOH 水溶液;
(2)C的结构简式为![]() ;
;
(3)F为CH3CH2CHClCOOH,官能团名称为氯原子、羧基;
(4)上述①~⑧的反应中,属于取代反应的有①②③④⑦;⑤属于氧化反应,⑥属于消去反应,⑧属于加聚反应,故不属于取代反应的是⑤⑥⑧;反应⑦的化学方程式为![]() ;
;
(5)B为对硝基甲苯,符合下列条件的的同分异构体①苯环上有氨基(—NH2) ②能发生银镜反应,则含有醛基,若除氨基外为HCOO-,则有邻、间、对位3种结构;若三个取代基,则除氨基外还有一个醛基和一个羟基,先将两个取代基定在邻、间、对位,则另一个取代基取代后的结构分别有4、4、2共10种,合计同分异构体有13种;其中核磁共振氢谱有4组峰,且峰面积比为2∶2∶2∶1的结构简式为![]() ;
;
(6)参照上述合成路线, 1-丁烯与氯气加热条件生成CH3CHClCH=CH2,CH3CHClCH=CH2在五氧化二钒催化下氧化得到CH3CHClCOOH,CH3CHClCOOH在氢氧化钾的醇溶液中加热后酸化得到丙烯酸,其合成路线如下![]() 。
。




