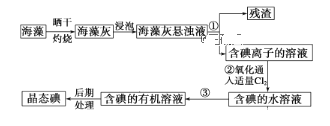
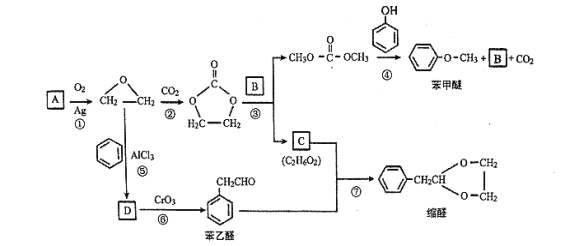
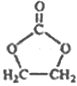
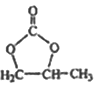
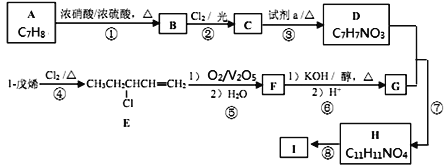
题目内容
【题目】(1)现有下列五种物质A.食盐, B.食醋,C.苹果汁,D.葡萄糖,E.青霉素,请按下列要求填空(填序号)。
富含维生素C的是____;可直接进入血液,补充能量的是___ ;应用最广泛的抗生素之一的是____;即可作为调味剂,又可作为防腐剂、着色剂的是____;食用过多会引起血压升高、肾脏受损的____。
(2)已知维生素A1的键线式如下,线的交点与端点处代表碳原子,并用氢原子补足四价,但C、H原子未标记出来。

回答下列问题:
①维生素A是一类重要的维生素,又称视黄醇,它属于_____(填“水溶性”或“脂溶性”)维生素;如果人体内缺少维生素A,易患_____等眼疾(任写一种), 维生素A含量较高的蔬菜有______。
②维生素A1的结构简式如上图,推测它____使溴水褪色(填“能”或“否”),若1mol维生素A1分子最多可跟_____mol H2发生加成反应。
(3)保持洁净安全的生存环境已成为全人类的共识。
①为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行______。对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为______。
②获得洁净安全的饮用水是每个人的正常需要。某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为_______。
③人类产生的垃圾应进行分类回收、集中处理,即便如此,仍会剩余不少垃圾,因此必须对剩余垃圾进一步处理,除卫生填埋外,还有一种能够改变垃圾的组成、结构使其体积减小、充分利用其所具有的能量并使之无害化的处理方式,这种垃圾的处理方式是_____技术。
【答案】C D E B A 脂溶性 夜盲症或干眼症 胡萝卜 能 5 脱硫处理 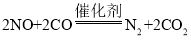 Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO 垃圾焚烧发电
Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO 垃圾焚烧发电
【解析】
(1)依据人体基本营养物质与用途作答;
(2)①维生素A是脂溶性维生素,缺乏会患夜盲症,胡萝卜富含维生素A;
②根据分子的结构简式可知,分子内含碳碳双键,一个碳碳双键可与一个氢气发生加成反应;
(3)①可在煤中添加石灰石进行脱硫处理,汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,生成N2和CO2;
②漂白粉与空气接触后,会和二氧化碳水反应生成碳酸钙和次氯酸,次氯酸具有强氧化性,能进行杀菌消毒漂白;
③充分利用其所具有的能量并使之无害化的处理方式,可将热能转化为电能。
(1)果汁中含维生素C;葡萄糖为营养物质,可直接进入血液补充能量;青霉素为常用的抗生素药物;醋既可作为着色剂,又可作为防腐剂;食盐食用过多会引起血压升高、肾脏受损;
(2)①维生素A是脂溶性维生素,缺乏会患夜盲症或干眼症,胡萝卜、番茄等富含维生素A;
②维生素A分子内含碳碳双键,可使溴水褪色,1个该分子内含5个碳碳双键,故1mol维生素A1分子最多可跟5mol H2发生加成反应;
(3)①可在煤中添加石灰石进行脱硫处理,生成硫酸钙,汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,生成N2和CO2,反应的方程式为: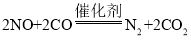 ;
;
(2)碳酸酸性强于次氯酸,漂白粉与空气接触后,会和二氧化碳水反应生成碳酸钙和次氯酸,次氯酸具有强氧化性,能进行杀菌消毒漂白,反应的化学方程式为:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO;
(3)充分利用其所具有的能量并使之无害化的处理方式,可将热能转化为电能,该技术为垃圾焚烧发电技术。

 名校课堂系列答案
名校课堂系列答案【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H = - 574 kJ/mol
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H = - 1160 kJ/mol
③H2O(g) = H2O(l) △H = - 44.0 kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式: _____________________________________________________________。
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________________(填代号)。

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH=a kJ/mol
N2(g)+CO2(g) ΔH=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(NO)=_____________________;计算该反应的平衡常数K=____________________。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_________(填字母代号)。
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率____________(填“升高”或“降低”),a________0(填“>”或“<”)。
(4)温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
测得有关数据如下表:
温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法正确的是__________________。
A.T1>T2,且b>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)