题目内容
6.某500mL溶液中含0.1mol Fe2+、0.2mol Fe3+,加入0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)( )| A. | 0.4 mol•L-1 | B. | 0.6 mol•L-1 | C. | 0.8 mol•L-1 | D. | 1.0 mol•L-1 |
分析 发生反应为:Fe+2Fe3+═3Fe2+,进行过量计算,根据不足量的物质计算反应生成的Fe2+的物质的量,进而得到溶液中Fe2+的总物质的量,再根据c=$\frac{n}{V}$求出反应后溶液中Fe2+的物质的量浓度.
解答 解:由Fe+2Fe3+═3Fe2+可知,0.2mol完全反应消耗Fe3+的物质的量为:0.2mol×2=0.4mol>0.2mol,故铁粉过量,Fe3+不足,根据Fe3+计算生成Fe2+的物质的量,则:
Fe+2Fe3+═3Fe2+
0.2mol 0.3mol
所以反应后溶液中Fe2+的总物质的量为:0.1mol+0.3mol=0.4mol,
所以c(Fe2+)=$\frac{0.4mol}{0.5L}$=0.8mol/L,
故选C.
点评 本题考查离子反应的计算、物质的量浓度的计算,题目难度中等,根据反应物的量及离子方程式判断过量为解答关键,注意掌握物质的量浓度的概念及计算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列关于物质的性质和用途的叙述中,不正确的是( )
| A. | 硅胶吸附能力很强,常用作袋装食品、瓶装药品的干燥剂 | |
| B. | 氧化铝熔点很高,可用来制作耐火坩埚及耐高温实验仪器 | |
| C. | 二氧化硫能使品红溶液褪色,将氯气通入二氧化硫的饱和溶液中可增强其漂白性 | |
| D. | 硅导电性介于导体和绝缘体之间,是良好的半导体材料 |
8.已知碱能除去硝酸尾气:NO+NO2+2NaOH═2NaNO2+H2O、2NO2+2NaOH═NaNO2+NaNO3+H2O,根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液吸收的是( )
| A. | 1mol O2和4mol NO2 | B. | 1mol O2和4mol NO | ||
| C. | 1mol NO和5mol NO2 | D. | 4mol NO和1mol NO2 |
14.乙烯(C2H4)、乙酸(C2H4O2)和甲醛(CH2O)组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为( )
| A. | 27% | B. | 28% | C. | 54% | D. | 无法计算 |
1.下列叙述正确的是( )
| A. | 只含有共价键的物质都是共价化合物 | |
| B. | 共价化合物中一定没有离子键 | |
| C. | 凡是在水溶液中能电离出离子的化合物都是离子化合物 | |
| D. | 离子化合物中一定没有共价键 |
11.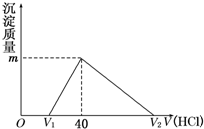 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )| A. | 原合金质量为0.92g | B. | 产生氢气0.04mol | ||
| C. | 图中m值为1.56g | D. | 图中V2为60 mL |
15.设NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A. | 53g Na2C03固体中含有的离子数总数为1.5NA | |
| B. | 78 g Na2O2与足量的水充分反应,转移的电子数目为NA | |
| C. | 46 g NO2 和 N2O4混合气体中含有原子数为3NA | |
| D. | 在标准状况下,22.4 L SO3中含原子数为4 NA |
16.如表为元素周期表的一部分,參照元素①-⑤在表中的位置,下列判断正确的是( )
| 族 周期 | IA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ||||
| A. | 金属性③>② | B. | ④原子核外有4个电子层 | ||
| C. | 原子半径⑤>③ | D. | 元素①④最高化合价相等 |
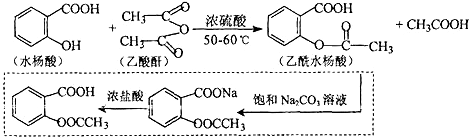
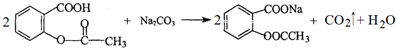 .
.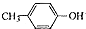 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: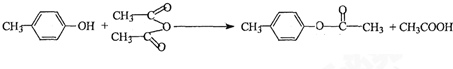 .
.