题目内容
15.现有浓度、体积均相等的HCl溶液A和CH3COOH溶液B.试回答下列问题(填“<”“=”或“>”):(1)这两种溶液的pH大小关系为A<B;
(2)A和B分别与足量的金属铁反应,反应速率的大小关系为A>B,完全反应后,产生气体的体积(相同状况)的大小关系为A=B;
(3)A、B溶液中分别加入0.10mol/L NaOH溶液至恰好完全反应,所需NaOH溶液体积的大小关系为A=B.
分析 盐酸是一元强酸,醋酸是一元弱酸,浓度、体积均相等的盐酸和醋酸中,所含溶质的物质的量相同,中和碱的能力相同,但氢离子浓度盐酸远远大于醋酸,据此分析.
解答 解:(1)盐酸是一元强酸,醋酸是一元弱酸,浓度相同的两种溶液中,氢离子浓度盐酸远远大于醋酸,所以盐酸的pH小于醋酸,故答案为:<;
(2)浓度、体积均相等的盐酸和醋酸中,所含溶质的物质的量相同,与Fe反应时,最终电离出来的氢离子物质的量相同,但氢离子浓度盐酸远远大于醋酸,所以
A和B分别与足量的金属铁反应,开始时反应速率盐酸大于醋酸,最终生成氢气体积盐酸等于醋酸,故答案为:>;=;
(3)浓度、体积均相等的盐酸和醋酸中,所含溶质的物质的量相同,中和碱的能力相同,所以浓度、体积均相等的盐酸和醋酸溶液中分别加入0.10mol/L NaOH溶液至恰好完全反应,所需NaOH溶液体积相同,故答案为:=.
点评 本题考查了强弱电解质的区别,注意相同物质的量的盐酸与醋酸中和碱的能力相同,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
5.用如图所示装置及药品进行相应实验,能达到实验目的是( )
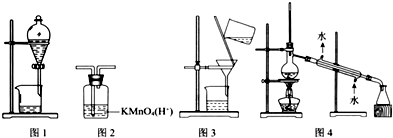

| A. | 图1(分离乙醇和乙酸) | B. | 图2(除去乙炔中的乙烯) | ||
| C. | 图3(除去溴苯中的溴单质) | D. | 图4(除去工业酒精中的甲醇) |
6.已知反应Cl2+H2O═HCl+HClO,对该反应的说法正确的是( )
| A. | Cl2是氧化剂,H2O是还原剂 | |
| B. | 氧化剂与还原剂的物质的量之比是1:2 | |
| C. | 按照化学方程式进行,氧化剂失电子1 mol | |
| D. | Cl2既是氧化剂又是还原剂 |
3.30mL0.1mol•L-1的Na2SO3溶液恰好将2×10-3molXO4-还原,则在还原产物中,X元素的化合价是( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
10.某种药物合成中间体结构简式为: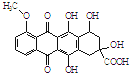 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )
 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )| A. | 属于芳香族化合物 | |
| B. | 能发生消去反应和酯化反应 | |
| C. | 1 mol该有机物与足量NaOH溶液反应,消耗5 mol NaOH | |
| D. | 能分别与金属Na、NaHCO3溶液反应 |
20.某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系).
请你帮助该同学整理并完成实验报告.
(1)实验目的:探究同周期元素性质的递变规律.
(2)实验用品 试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液等.
仪器:①试管,②滴管,③烧杯,试管夹,镊子,小刀,玻璃片,砂纸等.
(3)实验内容:(填写与实验步骤对应的实验现象的标号和化学方程式)
(4)实验结论同周期元素,从左到右,金属性逐渐减弱,非金属性逐渐增强.
(5)请用原子结构的知识简单解释上述结论同周期元素,从左到右,核电荷数依次增大,原子半径依次减小.原子失电子的能力依次减弱,得电子的能力依次增强.
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,做不定向移动,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
(1)实验目的:探究同周期元素性质的递变规律.
(2)实验用品 试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液等.
仪器:①试管,②滴管,③烧杯,试管夹,镊子,小刀,玻璃片,砂纸等.
(3)实验内容:(填写与实验步骤对应的实验现象的标号和化学方程式)
| 实验内容 | 实验现象 | 化学方程式 |
| ① | ||
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | ||
| ⑥ |
(5)请用原子结构的知识简单解释上述结论同周期元素,从左到右,核电荷数依次增大,原子半径依次减小.原子失电子的能力依次减弱,得电子的能力依次增强.
7. 氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,下列说法正确的是( )
氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,下列说法正确的是( )
 氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,下列说法正确的是( )
氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,下列说法正确的是( )| A. | NH3分子内可以形成氢键,故NH3很容易液化 | |
| B. | a电极的电极反应式为:NH3-5e-+5OH-═NO+4H2O | |
| C. | 正极消耗标准状况下空气2.24L时,电池中转移的电子数目为0.4NA | |
| D. | 反应过程中,K+向b极移动.一段时间后,电解质溶液的pH将减小 |
 酸、碱、盐都是电解质,在水中都能电离出离子.
酸、碱、盐都是电解质,在水中都能电离出离子.