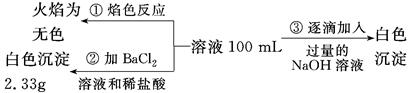
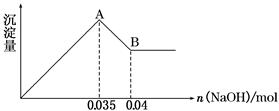
题目内容
将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应。求:
(1)所用盐酸中HCl的物质的量浓度
(2)反应中生成的H2在标准状况下的体积
(3)在反应后的溶液中通入Cl2,写出所发生反应的化学方程式并用双线桥标出电子转移的方向和数目:
(1)C(HCl)= 2mol·L-1(2分)
(2) V(H2)=4.48L(2分)
(3)2FeCl2+Cl2=2FeCl3  (方程式写对2分,双线桥表示2分)
(方程式写对2分,双线桥表示2分)
解析试题分析:Fe + 2HCl=FeCl2 + H2↑
56 2 22.4
11.2g n(HCl) v(H2)
所以C(HCl)= 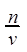 =2mol·L-1, v(H2)=4.48L
=2mol·L-1, v(H2)=4.48L
考点:金属与酸的反应,氧化还原反应的。

练习册系列答案
相关题目
现用98%的浓H2SO4(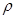 =1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL。
(1)请将下列操作按正确的序号填在横线上:
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.用胶头滴管加水至刻度 |
| D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶 |
F.将溶液转入容量瓶
其操作正确顺序为_____________
(2)简要回答下列问题:
①所需浓H2SO4的体积为________mL。
②如果实验室有15mL, 20mL, 25mL的量筒,选用_______mL的量筒最好。量取时发现量筒不干净,用水洗净后直接量取将使实验最终结果______(填“偏高”、“偏低”或“无影响”)。
③将浓H2SO4沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是_______,若搅拌过程中有液体溅出,会使最终结果_______(填“偏高”、“偏低”或“无影响”)。
④在转入容量瓶前烧杯中液体应_______,否则会使浓度_______;洗涤烧杯2~3次,洗液也要转入容量瓶,否则会使最终结果_______(填“偏高”、“偏低”或“无影响”)。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使结果_______,仰视会使结果_______(填“偏高”、“偏低”或“无影响”)。