题目内容
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: (已知:NH4HCO3![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
 请回答下列问题:
请回答下列问题:
(1)操作①加热的目的是________________
(2)操作②除用BaCl2溶液外,还可用________。
(3)操作②,判断SO42-已除尽的方法是_____________________________。
(4)操作③的目的是____________,不先过滤后再加Na2CO3溶液的理由是_________。
(5)操作④的名称是______________。
【答案】加热分解除去NH4HCO3Ba(OH)2溶液取上层清液加入BaCl2溶液,若无沉淀说明SO42-已除尽除去过量的Ba2+减少一次过滤操作蒸发结晶
【解析】
(1)操作①加热的目的是利用碳酸氢铵受热分解生成氨气、二氧化碳、水蒸气除去碳酸氢铵固体;发生的是碳酸氢铵分解的反应,发生反应的化学方程式为NH4HCO3![]() NH3↑+H2O+CO2↑;
NH3↑+H2O+CO2↑;
(2)操作②是完全沉淀硫酸根离子,原则是加入的试剂不能引入新的杂质,或最后易于除去,除了用BaCl2溶液外,也可以用Ba(OH)2溶液;
(3)操作②是完全沉淀硫酸根离子,由于硫酸钡不溶于水也不溶于酸,因此判断硫酸根离子已除尽的方法是取上层清液加入BaCl2溶液,若无沉淀说明SO42-已除尽;
(4)操作③是加入碳酸钠溶液,目的是除去过量的钡离子,避免引入钡离子杂质,所以加入碳酸钠的目的是除去过量的Ba2+,反应的离子方程式为:Ba2++CO32-=BaCO3↓;不先过滤后再加Na2CO3溶液的理由是可减少一次过滤操作;
(5)操作④是对饱和食盐水加热蒸发、浓缩结晶得到氯化钠晶体。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
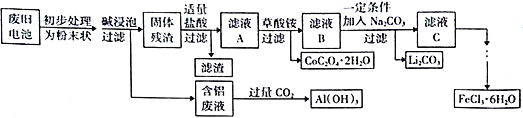
已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________________________________________。
(2)从含铝废液得到Al(OH)3的离子反应方程式为__________________________________。
(3)滤液A中的溶质除HCl、LiCl外还有__________(填化学式)。写出LiCoO2和盐酸反应的化学方程式__________________________________。
(4)滤渣的主要成分为____________________(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120-220 | CoC2O4·2H2O | 19.67% |
Ⅱ | 300~350 | _________________________ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为___________mol·L-1
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是_________________________。

