题目内容
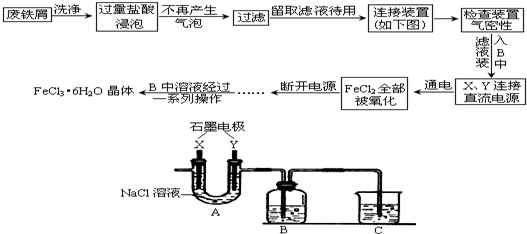
7. 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间的变化如图所示.下列说法正确的是( )
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间的变化如图所示.下列说法正确的是( )| A. | 反应方程式中的x=1 | |
| B. | t2时刻改变的条件是使用催化剂 | |
| C. | t3时刻改变的条件是移去少量物质D | |
| D. | t1~t3间该反应的平衡常数均为4 |
分析 A.t2时刻C的浓度增大,浓度不变说明平衡不移动,应是增大压强造成的,压强不影响该平衡;
B.使用催化剂不影响C浓度;
C.D为固体,减少D的量,不影响平衡移动;
D.t1~t3间温度相同,平衡常数相同,计算t1时反应混合物的浓度,代入平衡常数k=$\frac{{c}^{2}(C)}{c(A)×c(B)}$计算.
解答 解:A.t2时刻C的浓度增大,浓度不变说明平衡不移动,应是增大压强造成的,压强不影响该平衡,所以有x=1+1=2,故A错误;
B.加入催化剂C的浓度不发生变化,故B错误;
C.D为固体,减少D的量,不影响平衡移动,C的浓度不发生变化,故C错误;
D.t1~t3间温度相同,平衡常数相同,由图可知平衡时C的浓度为0.5mol/L,则:
A(g)+B(g)?2C(g)+D(s)
开始(mol/L):0.5 0.5 0
变化(mol/L):0.25 0.25 0.5
平衡(mol/L):0.25 0.25 0.5
所以平衡常数k=$\frac{{c}^{2}(C)}{c(A)×c(B)}$=$\frac{0.{5}^{2}}{0.25×0.25}$=4,故D正确;
故选:D.
点评 本题考查化学平衡计算与影响因素、平衡常数等,难度中等,关键是理解外界条件对化学平衡的影响.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
3.将一小块Na投入到足量的CuSO4溶液中,现象描述正确的是( )
| A. | 置换出金属铜 | B. | 产生气体,置换出金属铜 | ||
| C. | 只生成蓝色沉淀 | D. | 产生气体,生成蓝色沉淀 |
16.25℃时,在1.0L浓度均为0.01mol•L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中,错误的是( )
| A. | c(A-)+c(HA)=0.02 mol•L-1 | B. | 该溶液的pH<7 | ||
| C. | HA的酸性很弱,A-水解程度较大 | D. | n(A-)+n(OH-)-n(H+)=0.01 mo1 |
17.汽车安全气囊碰撞时会发生如下反应:10NaN3+2KNO3=5Na2O+X+16N2↑,则下列说法正确的是( )
| A. | X的化学式为:K2O2 | B. | KNO3发生氧化反应 | ||
| C. | NaN3的电子式为 | D. | 氧化产物与还原产物质量比为1:15 |
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习