题目内容
17.汽车安全气囊碰撞时会发生如下反应:10NaN3+2KNO3=5Na2O+X+16N2↑,则下列说法正确的是( )| A. | X的化学式为:K2O2 | B. | KNO3发生氧化反应 | ||
| C. | NaN3的电子式为 | D. | 氧化产物与还原产物质量比为1:15 |
分析 10NaN3+2KNO3=5Na2O+X+16N2↑,根据原子守恒得出X的化学式为:K2O,NaN3氮元素化由-$\frac{1}{3}$升高到N2中的0价,是还原剂,发生氧化反应,对应氧化产物;2KNO3中氮化合价由+5降低到N2中的0价,是氧化剂,发生还原反应,对应还原产物,据此解答.
解答 解:A.10NaN3+2KNO3=5Na2O+X+16N2↑,根据原子守恒得出X的化学式为:K2O,故A错误;
B.NaN3氮元素化由-$\frac{1}{3}$升高到N2中的0价,是还原剂,发生氧化反应,故B错误;
C.NaN3的电子式为 ,故C正确;
,故C正确;
D.该反应中10molNaN3是还原剂,生成氧化产物N2的物质的量是15mol;2molKNO3是氧化剂,生成还原产物N2的物质的量是1mol,氧化产物与还原产物物质的量之比为15:1,故D错误;
故选C.
点评 本题考查了氧化还原反应相关的概念,属于基础知识考查,明确发生的反应及反应中元素的化合价变化即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.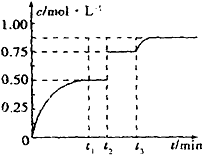 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间的变化如图所示.下列说法正确的是( )
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间的变化如图所示.下列说法正确的是( )
 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间的变化如图所示.下列说法正确的是( )
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间的变化如图所示.下列说法正确的是( )| A. | 反应方程式中的x=1 | |
| B. | t2时刻改变的条件是使用催化剂 | |
| C. | t3时刻改变的条件是移去少量物质D | |
| D. | t1~t3间该反应的平衡常数均为4 |
8.下列叙述或离子方程式书写正确的是( )
| A. | 将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+3ClO-═SO42-+Cl-+2HClO | |
| B. | 用氨水溶解氯化银沉淀:Ag++2 NH3•H2O═[Ag(NH3)2]++2H2O | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH4++SO42-═BaSO4↓+2NH3•H2O |
6.试管中盛有少量白色固体,可能是铵盐,检验的方法是( )
| A. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| B. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| C. | 加氢氧化钠溶液,加热,将干燥的红色石蕊试纸靠近试管口 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸靠近试管口 |
7.下列关于金属钠的叙述中,正确的是( )
| A. | 钠具有银白色的金属光泽,熔点高于100℃ | |
| B. | 钠具有强还原性,能与CuSO4溶液发生置换反应生成Cu | |
| C. | 将金属钠在空气中加热则生成白色固体 | |
| D. | 钠钾合金在室温下呈液态,可用做原子反应堆的导热剂 |
 如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.
如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.