题目内容
【题目】许多金属及其化合物在生活、化工、医药、材料等各个领域有着广泛的应用。
(1)钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度,被美誉为“未来钢铁”、“战略金属”。钛基态原子中电子占据最高能级的符号为________。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有_______种。钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是___________________。
(2)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图所示,该晶胞中N、Ti之间的最近距离为a×10-10 cm,则该氮化钛的密度为______ g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。

(3)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。Li2O是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。
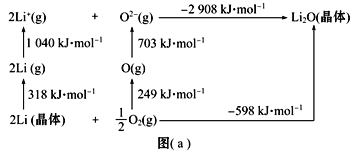
Li原子的第一电离能为______kJ·mol-1,O![]() O键键能为_____kJ·mol-1,Li2O晶格能为____kJ·mol-1。
O键键能为_____kJ·mol-1,Li2O晶格能为____kJ·mol-1。
【答案】3d 3 钛原子的价电子数比Al多,金属键更强 ![]() 520 498 2908
520 498 2908
【解析】
(1) 钛原子核外有22个电子,根据核外电子排布规律写出钛原子价电子排布式,再确定占据的最高能级;基态Ti原子的未成对电子数为2;第四周期中未成对电子数为2的元素有Ge、Se、Ni,有3种;钛原子的价电子数是4、铝原子的价电子数是3;
(2) 根据均摊法,可知该晶胞中N原子个数为6![]() +8
+8![]() =4,Ti原子个数为1+12
=4,Ti原子个数为1+12![]() =4,所以晶胞的质量为m=
=4,所以晶胞的质量为m=![]() g,而晶胞的体积V=(2a×10-10)3cm3,再根据
g,而晶胞的体积V=(2a×10-10)3cm3,再根据![]() =
=![]() 计算;
计算;
(3) Li原子的第一电离能是指1mol气态锂原子失去1mol电子变成1mol气态锂离子所吸收的能量;O![]() O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量;晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,以此解答。
O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量;晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,以此解答。
(1) 钛原子核外有22个电子,基态钛原子价电子排布式为3d24s2,占据最高能级的符号为3d;基态原子的未成对电子数为2;第四周期中未成对电子数为2的元素有Ge、Se、Ni,有3种;钛原子的价电子数是4、铝原子的价电子数是3,钛原子的价电子数比铝多,金属键更强,所以钛的硬度比铝大;
因此,本题正确答案是:3d;3;钛原子的价电子数比Al多,金属键更强;
(2) 根据均摊法,可知该晶胞中N原子个数为6![]() +8
+8![]() =4,Ti原子个数为1+12
=4,Ti原子个数为1+12![]() =4,所以晶胞的质量为m=
=4,所以晶胞的质量为m=![]() g,而晶胞的体积V=(2a×10-10)3cm3,所以晶胞的密度
g,而晶胞的体积V=(2a×10-10)3cm3,所以晶胞的密度![]() =
=![]() g·cm-3,
g·cm-3,
因此,本题正确答案是:![]() ;
;
(3) Li原子的第一电离能是指1mol气态锂原子失去1mol电子变成1mol气态锂离子所吸收的能量,即为![]() =520kJ·mol-1;O=O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量,即为249kJ·mol-1
=520kJ·mol-1;O=O键键能是指1mol氧气分子断裂生成气态氧原子所吸收的能量,即为249kJ·mol-1![]() =498 kJ·mol-1。晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,则Li2O晶格能为2908kJ·mol-1。
=498 kJ·mol-1。晶格能是指气态离子结合生成1mol离子晶体所释放的能量或1mol离子晶体断裂离子键形成气态离子所吸收的能量,则Li2O晶格能为2908kJ·mol-1。
因此,本题正确答案是:520 ;498 ;2908。

 发散思维新课堂系列答案
发散思维新课堂系列答案