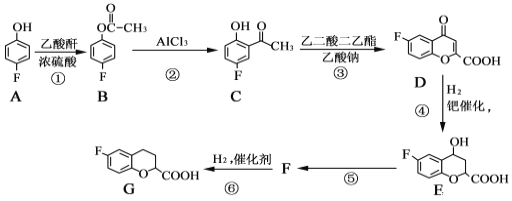
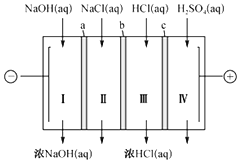
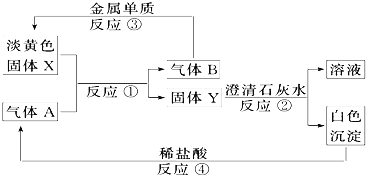
题目内容
【题目】将10mL98%浓硫酸(密度为1.84g/mL)加水稀释至1L,然后向溶液中加入6.5g锌粒。
(1)稀释后硫酸溶液中H+的物质的量浓度是_________________?
(2)标出反应中电子转移方向及数目___________,并计算生成气体在标况下的体积是_____________?
【答案】0.368mol/L 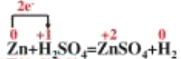 2.24L
2.24L
【解析】
(1)、浓硫酸的物质的量浓度为:![]() ,根据稀释前后溶质的物质的量不发生改变可知:c1V1=c2V2,稀释后的硫酸浓度为:
,根据稀释前后溶质的物质的量不发生改变可知:c1V1=c2V2,稀释后的硫酸浓度为:![]() ,则H+的物质的量浓度是0.368mol/L,故答案为:0.368mol/L;
,则H+的物质的量浓度是0.368mol/L,故答案为:0.368mol/L;
(2)、标出反应中电子转移方向及数目即单线桥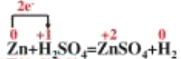 ;,6.5g锌的物质的量为:
;,6.5g锌的物质的量为:![]() ,硫酸的物质的量为:0.184mol/L×1L=0.184mol,根据反应Zn+H2SO4═ZnSO4+H2↑可知,硫酸过量,所以产生氢气的物质的量为0.1mol,在标况下的体积是:0.1mol×22.4L/mol=2.24L, 故答案为:
,硫酸的物质的量为:0.184mol/L×1L=0.184mol,根据反应Zn+H2SO4═ZnSO4+H2↑可知,硫酸过量,所以产生氢气的物质的量为0.1mol,在标况下的体积是:0.1mol×22.4L/mol=2.24L, 故答案为: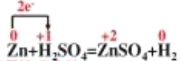 ;2.24L。
;2.24L。

【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.0 kJ·mol1
2NO(g) ΔH=+180.0 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热为 _________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为 ____________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A.2υ正(NO2)=υ逆(N2)
B. 混合气体的平均相对分子质量保持不变
C.气体总压强不再变化
D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___molL1min1。
③25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
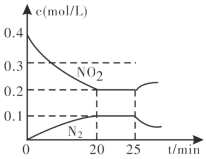
A.缩小容器体积
B.增加NO2的浓度
C.降低温度
D.升高温度