题目内容
【题目】Ⅰ.有下列各组物质:
A.O2和O3 B.![]() 和
和![]()
C.![]() 和
和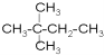
D.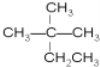 和
和 E.丁烷和新戊烷
E.丁烷和新戊烷
F.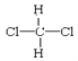 和
和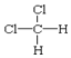 G.甲烷和庚烷
G.甲烷和庚烷
其中属于同分异构体的是____;属于同系物的是____;属于同种物质的是_____;属于同位素的是_______;属于同素异形体的是______。
Ⅱ.根据所学的有机化学反应类型,将下列反应进行归类,并按要求写出部分反应。
①由乙烯和HCl制氯乙烷 ②乙烷在空气中燃烧
③乙烯使溴水褪色 ④乙烯通入酸性高锰酸钾溶液
⑤乙烷与氯气光照 ⑥苯与硝酸在浓硫酸作用的条件下的反应
⑦苯与H2在镍作催化剂加热条件下的反应
⑧乙醇在铜作催化剂加热条件下与氧气的反应
(1)其中属于取代反应的有_____;属于氧化反应的有______;属于加成反应的有______。
(2)分别写出③⑥⑦的化学反应方程式:
③__________________
⑥__________________
⑦__________________
【答案】C E、G D、F B A ⑤⑥ ②④⑧ ①③⑦ CH2=CH2+Br2![]() CH2BrCH2Br;
CH2BrCH2Br; 

【解析】
Ⅰ.具有相同分子式而结构不同的化合物互为同分异构体;
结构相似、分子组成相差1个或若干个“CH2”原子团的化合物互称为同系物;
分子式相同结构相同的物质属于同一物质;
有相同质子数,不同中子数的核素互为同位素;
相同元素组成的性质不同的单质互为同素异形体,据此分析作答。
Ⅱ.(1)有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;氧化反应:有机物得氧或失氢的反应为氧化反应;有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应,根据定义进行判断。
(2)依据反应类型书写其化学方程式,注意反应条件。
Ⅰ.根据定义分析可知,
O2和O3都是由氧元素形成的不同单质,故互为同素异形体;
![]() 和
和![]() 质子数相同,中子数不同,故互为同位素;
质子数相同,中子数不同,故互为同位素;
![]() 和
和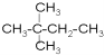 分子式相同都为C6H14,但结构不同,故互为同分异构体;
分子式相同都为C6H14,但结构不同,故互为同分异构体;
丁烷和新戊烷结构相似,分子组成上相差1个“CH2”原子团;甲烷和庚烷结构相似,分子组成相差6个“CH2”原子团,两者均互为同系物;
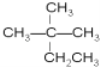 和
和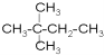 都表示2,2—二甲基丁烷、
都表示2,2—二甲基丁烷、  和
和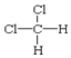 都表示二氯甲烷,均属于分子式相同,结构也相同,属于同一物质;
都表示二氯甲烷,均属于分子式相同,结构也相同,属于同一物质;
答案为:C;E、G;D、F;B;A
Ⅱ.(1)①由乙烯制氯乙烷,乙烯与氯化氢发生加成反应生成氯乙烷;
②乙烷在空气中完全燃烧生成二氧化碳和水,乙烷发生氧化反应;
③乙烯含有碳碳双键,使溴水褪色,发生加成反应;
④乙烯中含有碳碳双键,容易被强氧化剂氧化,当乙烯通入酸性高锰酸钾溶液时发生氧化反应;
⑤乙烷与氯气光照发生取代反应生成乙烷的氯代产物,该反应属于取代反应;
⑥苯与硝酸在浓硫酸作用的条件下发生硝化反应,该反应属于取代反应;
⑦苯与H2在镍作催化剂加热条件下反应生成环己烷,该反应属于加成反应;
⑧乙醇在铜作催化剂加热条件下与氧气反应生成乙醛和水,该反应属于氧化反应;
属于取代反应的有:⑤⑥;属于氧化反应的有:②④⑧;属于加成反应的有:①③⑦,
故答案为:⑤⑥;②④⑧;①③⑦;
(2)③为乙烯与溴发生加成反应生成1,2-二溴乙烷,其化学反应方程式:CH2=CH2+Br2![]() CH2BrCH2Br;
CH2BrCH2Br;
⑥苯与硝酸在浓硫酸作用发生硝化反应生成硝基苯与水,其化学方程式为: ;
;
⑦苯与H2在镍作催化剂加热条件下发生加成反应生成环己烷,其化学方程式为: 。
。

【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题:
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数 (25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是________。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)____________。
③向NaCN溶液通入少量CO2反应的化学方程式是_________________________________。
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是__________________________________________________;此时c(HCN)/c(CN-)=________。
②HCN溶液有挥发性,HCN是有剧毒的物质,实验室在做有关NaCN的实验时尽量不采用的实验条件是__________________。
A、冰水浴 B、加热 C、浓溶液 D、稀溶液 E、酸性条件 F、碱性条件
③常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是__________________________________。
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
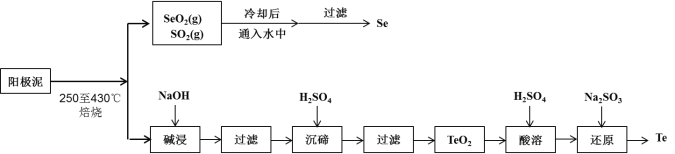
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)