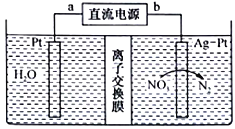
题目内容
【题目】图中A~J均为有机化合物,根据图中的信息,回答下列问题。
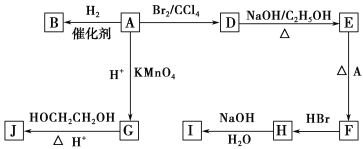
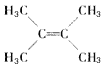
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.2%。B的一氯代物仅有一种,B的结构简式为_________________________。
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为__________________________________。
(3)由A生成D的反应类型是________,由D生成E的反应类型是________。
(4)G的分子式为C6H10O4,0.146 g G需用20 mL 0.100 mol·L-1 NaOH溶液完全中和, G 的结构简式为_________;
(5)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生如下反应:
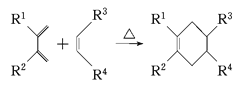
则由E和A反应生成F的化学方程式为______________________________________。
(6)H中含有的官能团是________,I中含有的官能团是________。
【答案】![]()
 加成反应消去反应
加成反应消去反应![]()
![]() 溴(或-Br)羟基(或-OH)
溴(或-Br)羟基(或-OH)
【解析】
根据A中碳氢含量知A是烃,A中碳原子个数=![]() =6,氢原子个数=
=6,氢原子个数=![]() =10,所以A的分子式为C6H10,A能和氢气发生加成反应生成B,说明A中含有碳碳双键,B的一氯代物仅有一种,说明环烷烃B没有支链,所以A的结构简式为
=10,所以A的分子式为C6H10,A能和氢气发生加成反应生成B,说明A中含有碳碳双键,B的一氯代物仅有一种,说明环烷烃B没有支链,所以A的结构简式为![]() ,B的结构简式为:
,B的结构简式为:![]() ;A和溴发生加成反应生成D,所以D的结构简式为:
;A和溴发生加成反应生成D,所以D的结构简式为:![]() ,D和氢氧化钠的醇溶液发生消去反应生成E,E能和A发生反应生成F,结合题给信息知,E的结构简式为:
,D和氢氧化钠的醇溶液发生消去反应生成E,E能和A发生反应生成F,结合题给信息知,E的结构简式为:![]() ,F的结构简式为:
,F的结构简式为:![]() ,F和HBr发生加成反应生成H,则H的结构简式为:
,F和HBr发生加成反应生成H,则H的结构简式为:![]() ,H和氢氧化钠的水溶液发生取代反应生成I,I的结构简式为:
,H和氢氧化钠的水溶液发生取代反应生成I,I的结构简式为:![]() ,A被酸性高锰酸钾氧化生成G,碳碳双键能被酸性高锰酸钾氧化生成羧酸,G的分子式为C6H10O4,0.146gG的物质的量=
,A被酸性高锰酸钾氧化生成G,碳碳双键能被酸性高锰酸钾氧化生成羧酸,G的分子式为C6H10O4,0.146gG的物质的量=![]() =0.001mol,20mL0.100mol/LNaOH的物质的量=0.100mol/L×0.02L=0.002mol,所以G中含有两个羧基,其结构简式为:HOOCCH2CH2CH2CH2COOH,G和乙二醇反应生成J,J是一种高分子化合物,所以J的结构简式为:
=0.001mol,20mL0.100mol/LNaOH的物质的量=0.100mol/L×0.02L=0.002mol,所以G中含有两个羧基,其结构简式为:HOOCCH2CH2CH2CH2COOH,G和乙二醇反应生成J,J是一种高分子化合物,所以J的结构简式为:![]() 。
。
(1)通过以上分析知,B的结构简式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,说明含有碳碳双键,分子中所有的碳原子共平面,则M中的碳碳双键位于中间,相当于乙烯中的氢原子被甲基取代,所以则M的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)A和溴发生加成反应生成D,D和氢氧化钠的醇溶液发生消去反应生成E,故答案为:加成反应;消去反应;
(4)G和乙二醇反应生成J,J是一种高分子化合物,则该反应是缩聚反应,反应方程式为:![]() ,故答案为:img src="http://thumb.zyjl.cn/questionBank/Upload/2019/04/19/09/befce3b6/SYS201904190935129193883298_DA/SYS201904190935129193883298_DA.017.png" width="418" height="47" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />;
,故答案为:img src="http://thumb.zyjl.cn/questionBank/Upload/2019/04/19/09/befce3b6/SYS201904190935129193883298_DA/SYS201904190935129193883298_DA.017.png" width="418" height="47" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />;
(5)A和E发生加聚反应生成F,该反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(6)H的结构简式为:![]() ,所以H中含有的官能团是溴原子(-Br),I的结构简式为:
,所以H中含有的官能团是溴原子(-Br),I的结构简式为:![]() ,I中含有的官能团是羟基(-OH),故答案为:-Br;-OH。
,I中含有的官能团是羟基(-OH),故答案为:-Br;-OH。

【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题:
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数 (25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是________。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)____________。
③向NaCN溶液通入少量CO2反应的化学方程式是_________________________________。
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是__________________________________________________;此时c(HCN)/c(CN-)=________。
②HCN溶液有挥发性,HCN是有剧毒的物质,实验室在做有关NaCN的实验时尽量不采用的实验条件是__________________。
A、冰水浴 B、加热 C、浓溶液 D、稀溶液 E、酸性条件 F、碱性条件
③常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是__________________________________。
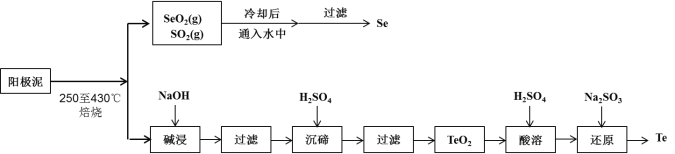
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)