题目内容
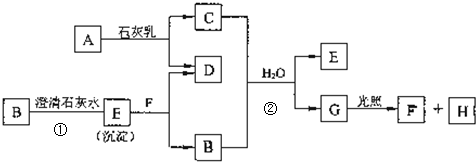
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
①G是一种红棕色粉末、也是铁锈的主要成份;C既能与盐酸又能与NaOH溶液反应
②I是一种常见的温室气体,它和E可以发生反应:2E+I
2F+D,F中的E元素的质量分数为60%.

回答问题:
(1)G→H反应在工业上常用于焊接钢轨,写出G→H的化学方程式为 ;
(2)写出H生成N的离子反应 ;
(3)用适量的盐酸溶解G后,所得溶液叫蚀铜剂,常用来洗涤印刷电路板上的铜,写出该反应的离子方程式为 和 ;
(4)写出K生成L的化学反应 ;
(5)写出L生成M的化学反应 ;
(6)如果将N和P两种物质的溶液混合,会产生白色沉淀,用离子方程式表示为 .
①G是一种红棕色粉末、也是铁锈的主要成份;C既能与盐酸又能与NaOH溶液反应
②I是一种常见的温室气体,它和E可以发生反应:2E+I
| ||

回答问题:
(1)G→H反应在工业上常用于焊接钢轨,写出G→H的化学方程式为
(2)写出H生成N的离子反应
(3)用适量的盐酸溶解G后,所得溶液叫蚀铜剂,常用来洗涤印刷电路板上的铜,写出该反应的离子方程式为
(4)写出K生成L的化学反应
(5)写出L生成M的化学反应
(6)如果将N和P两种物质的溶液混合,会产生白色沉淀,用离子方程式表示为
考点:无机物的推断
专题:推断题
分析:①G是一种红棕色粉末、也是铁锈的主要成份,应为Fe2O3,C既能与盐酸又能与NaOH溶液反应,应为Al,则B为Fe,H为Al2O3,A为O2,结合转化关系可知P为AlCl3,N为NaAlO2,J为FeCl3,K为FeCl2,L为Fe(OH)2,M为Fe(OH)3;
②I是一种常见的温室气体,则I为CO2,它和E可以发生反应:2E+I
2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,然后结合元素化合物知识及化学用语来解答.
②I是一种常见的温室气体,则I为CO2,它和E可以发生反应:2E+I
| ||
解答:
解:①G是一种红棕色粉末、也是铁锈的主要成份,应为Fe2O3,C既能与盐酸又能与NaOH溶液反应,应为Al,则B为Fe,H为Al2O3,A为O2,结合转化关系可知P为AlCl3,N为NaAlO2,J为FeCl3,K为FeCl2,L为Fe(OH)2,M为Fe(OH)3;
②I是一种常见的温室气体,则I为CO2,它和E可以发生反应:2E+I
2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,
(1)G→H的化学方程式为2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe;
(2)H为Al2O3,可与氢氧化钠反应生成偏铝酸钠,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)用适量的盐酸溶解G后,所得溶液叫蚀铜剂,常用来洗涤印刷电路板上的铜,发生的反应有Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+,
故答案为:Fe2O3+6H+=2Fe3++3H2O;2Fe3++Cu=2Fe2++Cu2+;
(4)K生成L的化学反应方程式为FeCl2+2NH3?H2O=Fe(OH)2↓+2NH4Cl,故答案为:FeCl2+2NH3?H2O=Fe(OH)2↓+2NH4Cl;
(5)L生成M的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(6)N和P两种物质的溶液混合,发生互促水解反应生成氢氧化铝沉淀,反应的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O=4Al(OH)3↓.
②I是一种常见的温室气体,则I为CO2,它和E可以发生反应:2E+I
| ||
(1)G→H的化学方程式为2Al+Fe2O3
| ||
| ||
(2)H为Al2O3,可与氢氧化钠反应生成偏铝酸钠,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)用适量的盐酸溶解G后,所得溶液叫蚀铜剂,常用来洗涤印刷电路板上的铜,发生的反应有Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+,
故答案为:Fe2O3+6H+=2Fe3++3H2O;2Fe3++Cu=2Fe2++Cu2+;
(4)K生成L的化学反应方程式为FeCl2+2NH3?H2O=Fe(OH)2↓+2NH4Cl,故答案为:FeCl2+2NH3?H2O=Fe(OH)2↓+2NH4Cl;
(5)L生成M的化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(6)N和P两种物质的溶液混合,发生互促水解反应生成氢氧化铝沉淀,反应的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O=4Al(OH)3↓.
点评:本题考查无机物的推断,注意利用铝热反应及温室效应气体、Mg与二氧化碳的反应为解答本题的突破口,熟悉Mg、Al及其化合物的性质及氧化还原反应即可解答,题目难度中等.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
近日,包括合肥在内的大多城市发生持续雾霾天气,PM2.5数据监测受到了重视.PM2.5是指大气中直径小于2.5微米(1微米=10-6米)的可吸入肺的有害颗粒.下列说法不正确的是( )
| A、PM2.5主要来自工业生产,汽车尾气排放等过程中产生的残留物 |
| B、PM2.5表面积大,能吸附大量有害物质 |
| C、研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染 |
| D、我们要提倡先改善人们的生活质量,随着科技的发展再进行污染的治理 |
要除去下列四种物质中的少量杂质(括号内的物质为杂质):甲:CaCO3(Na2CO3);乙:NaOH(Na2CO3);丙:KCl(KHCO3);丁:碳粉(CuO)可选用的试剂及操作方法有:①加适量盐酸,搅拌,过滤;②加适量水,搅拌,过滤;③加适量盐酸,蒸发;④溶解,加适量石灰水,过滤,蒸发.下列组合正确的是( )
| A、甲-②,乙-④ |
| B、乙-③,丙-① |
| C、丙-①,丁-② |
| D、丁-②,丙-③ |
下列各组离子在特定条件下一定能够大量共存的是( )
| A、含有较多Fe3+的溶液:Na+、SO42-、HS-、NH4+ |
| B、c(OH-)=1mol/L的溶液:AlO2-、CH3COO-、K+、Ba2+ |
| C、pH=1的溶液:K+、Fe2+、NO3-、Na+ |
| D、遇Al能放出H2的溶液:HCO3-、K+、Mg2+、Cl- |
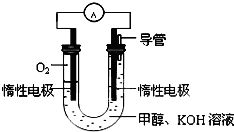 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.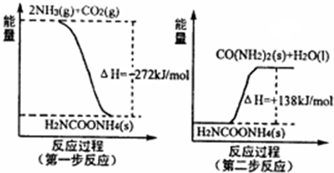 化学反应原理在工业生产中具有十分重要的意义.
化学反应原理在工业生产中具有十分重要的意义.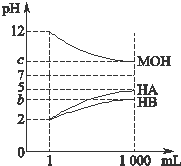 为研究HA、HB溶液和MOH的酸碱性的相对强弱,某化学学习小组设计了以下实验:室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图所示,根据所给数据,请回答下列问题:
为研究HA、HB溶液和MOH的酸碱性的相对强弱,某化学学习小组设计了以下实验:室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图所示,根据所给数据,请回答下列问题: