题目内容
 化学反应原理在工业生产中具有十分重要的意义.
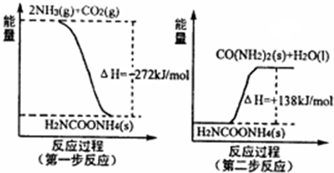
化学反应原理在工业生产中具有十分重要的意义.(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如图:
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ/mol测得在不同温度下,该反应的平衡常数K随温度的变化如表:
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
A.缩小反应器容积 B.增加Fe的物质的量 C.升高温度到900℃D.使用合适的催化剂.
考点:热化学方程式,化学平衡的影响因素,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题
分析:(1)根据盖斯定律来解答;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写反应①的平衡常数,注意固体不需要写出;由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,据此判断a值的符号;利用三段式表示出平衡时各组分的物质的量,再利用转化率定义求出转化率,根据v=
计算v(CO);
②根据外界条件对化学平衡移动的影响来回答.
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写反应①的平衡常数,注意固体不需要写出;由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,据此判断a值的符号;利用三段式表示出平衡时各组分的物质的量,再利用转化率定义求出转化率,根据v=
| △c |
| △t |
②根据外界条件对化学平衡移动的影响来回答.
解答:
解:(1)由图示可知,将两个反应相加可得2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol;
故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol;
(2)①反应Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常数K=
,由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故a>0,
令平衡时参加反应的二氧化碳的物质的量为xmol,则:
Fe(s)+CO2(g)═FeO(s)+CO(g)
开始(mol):4 4 0
变化(mol):x x x
平衡(mol):4-x 4-x x
500℃平衡常数为1,所以
=1,解得x=2,
故二氧化碳的转化率为
×100%=50%,
故CO表示的平均速率v(CO)=
=0.2mol/(L?min),
故答案为:
;>;50%;0.2mol/(L?min);
②A、缩小反应器容积,压强增大,化学平衡不移动,故A错误;
B.增加Fe的物质的量,不会引起化学平衡的移动,故B错误;
C.升高温度到900℃,化学平衡正向移动,故C正确;
D.使用合适的催化剂,不会引起化学平衡的移动,故D错误.
故选C.
故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol;
(2)①反应Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常数K=
| c(CO) |
| c(CO2) |
令平衡时参加反应的二氧化碳的物质的量为xmol,则:
Fe(s)+CO2(g)═FeO(s)+CO(g)
开始(mol):4 4 0
变化(mol):x x x
平衡(mol):4-x 4-x x
500℃平衡常数为1,所以
| x |
| 4-x |
故二氧化碳的转化率为
| 2 |
| 4 |
故CO表示的平均速率v(CO)=
| ||
| 5min |
故答案为:
| c(CO) |
| c(CO2) |
②A、缩小反应器容积,压强增大,化学平衡不移动,故A错误;
B.增加Fe的物质的量,不会引起化学平衡的移动,故B错误;
C.升高温度到900℃,化学平衡正向移动,故C正确;
D.使用合适的催化剂,不会引起化学平衡的移动,故D错误.
故选C.
点评:本题考查盖斯定律、化学反应速率和化学平衡移动方面的知识,属于综合知识的考查,难度大.

练习册系列答案
相关题目
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O
6Cu+SO2↑,关于该反应的说法中正确的是( )
| ||
| A、该反应的氧化剂只有Cu2O |
| B、每生成19.2g Cu,反应中转移0.6mol电子 |
| C、Cu既是氧化产物又是还原产物 |
| D、Cu2S在反应中既是氧化剂,又是还原剂 |
已知NH4NO3受到撞击或受热时会发生爆炸性分解:2NH4NO3═4H2O↑+2N2↑+O2↑.在反应中,被还原的原子和被氧化的原子的物质的量之比是( )
| A、3:5 | B、1:1 |
| C、1:2 | D、2:1 |
新能源的开发利用是人类社会可持续发展的重要课题.下列属于新能源的是( )
| A、太阳能 | B、煤炭 |
| C、天然气 | D、石油 |