题目内容
 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)═CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H1=-1451.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H2=-566.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
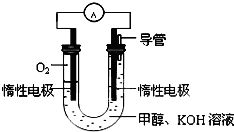
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:
①该电池的能量转化形式为
②工作一段时间后,测得溶液的pH减小.请写出该电池的负极的电极反应式.
③用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体.则原CuSO4溶液的物质的量浓度为
考点:反应热和焓变,热化学方程式,化学电源新型电池
专题:基本概念与基本理论
分析:(1)①由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应方向移动,正反应为放热反应;
②根据CO的平衡浓度计算平衡时CO的物质的量,进而计算参加反应的CO的物质的量,再根据转化率定义计算;列式三段式计算平衡浓度,结合平衡常数概念计算得到;
(2)根据热化学方程式和盖斯定律计算进行书写;
(3)①依据原电池原理分析能量变化为化学能转化为电能;
②燃料原电池中负极是燃料失去电子发生的氧化反应,工作一段时间后,测得溶液的pH减小,据此书写电极反应式;
③加氢氧化铜可以恢复原状态,说明硫酸铜被电解完全,并电解了部分水,据铜离子守恒求算.
②根据CO的平衡浓度计算平衡时CO的物质的量,进而计算参加反应的CO的物质的量,再根据转化率定义计算;列式三段式计算平衡浓度,结合平衡常数概念计算得到;
(2)根据热化学方程式和盖斯定律计算进行书写;
(3)①依据原电池原理分析能量变化为化学能转化为电能;
②燃料原电池中负极是燃料失去电子发生的氧化反应,工作一段时间后,测得溶液的pH减小,据此书写电极反应式;
③加氢氧化铜可以恢复原状态,说明硫酸铜被电解完全,并电解了部分水,据铜离子守恒求算.
解答:
解:(1)①由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应方向移动,正反应为放热反应,即△H1<0,
故答案为:<;
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L;达到平衡后,测得c(CO)=0.2mol/L,则参加反应的CO的物质的量=2mol-0.2mol/L×2L=1.6mol,故CO转化率=
×100%=80%,依据化学平衡三段式列式计算得到平衡浓度:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.8 1.6 0.8
平衡量(mol/L) 0.2 1.4 0.8
K=
=2.041对照图表数据判断温度为250℃;
故答案为:80%;250℃;
(2)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2 (g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
根据盖斯定律,①-②+③×4得2CH3OH(l)+2O2(g)=2CO(g)+4 H2O(l),该反应的反应热△H=-1275.6kJ?mol-1-(-566.0kJ?mol-1)+4×(-44.0kJ/mol)=-887kJ?mol-1
故该反应热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-442.8kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-442.8kJ?mol-1;
(3)①甲醇燃料电池是原电池反应能量是化学能转化为电能;
故答案为:化学能转化为电能;
②燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,负极上燃料失去电子发生氧化反应,工作一段时间后,测得溶液的pH减小,所以负极电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,故答案为:C2H5OH+3H2O-12e-=2CO2+12H+;
③加氢氧化铜可以恢复原状态,说明硫酸铜被电解完全,并电解了部分水,n(Cu2+)=n[Cu(OH)2]=
=0.1mol,所以,c(CuSO4)=
=0.2mol/L,故答案为:0.2.
故答案为:<;
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L;达到平衡后,测得c(CO)=0.2mol/L,则参加反应的CO的物质的量=2mol-0.2mol/L×2L=1.6mol,故CO转化率=
| 1.6mol |
| 2mol |
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.8 1.6 0.8
平衡量(mol/L) 0.2 1.4 0.8
K=
| 0.8 |
| 0.2×1.42 |
故答案为:80%;250℃;
(2)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2 (g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
根据盖斯定律,①-②+③×4得2CH3OH(l)+2O2(g)=2CO(g)+4 H2O(l),该反应的反应热△H=-1275.6kJ?mol-1-(-566.0kJ?mol-1)+4×(-44.0kJ/mol)=-887kJ?mol-1
故该反应热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-442.8kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-442.8kJ?mol-1;
(3)①甲醇燃料电池是原电池反应能量是化学能转化为电能;
故答案为:化学能转化为电能;
②燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,负极上燃料失去电子发生氧化反应,工作一段时间后,测得溶液的pH减小,所以负极电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,故答案为:C2H5OH+3H2O-12e-=2CO2+12H+;
③加氢氧化铜可以恢复原状态,说明硫酸铜被电解完全,并电解了部分水,n(Cu2+)=n[Cu(OH)2]=
| 9.8g |
| 98g?mol-1 |
| 0.1mol |
| 0.5L |
点评:本题考查了化学平衡常数的意义、转化率、盖斯定律、燃料电池、电极反应式书写,注重据此知识的考查,题目难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、胶体分散系与其它分散系的本质差别分散质直径大小 |
| B、胶体分散系与其它分散系的本质差别是否有丁达尔现象 |
| C、氧化还原反应的本质是反应前后有化合价的升降 |
| D、氧化还原反应的本质是反应前后有电子的得失 |
下列实验与对应示意图的关系正确的是( )
| A | B | C | D |
| NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
 |  |  |  |
| A、A | B、B | C、C | D、D |
 我国预计在2020年前后建成自己的载人空间站.为了实现空间站的零排放,循环利用人体呼出的CO2并提供氧气.我国科学家设计了一种装置(如图所示),实现“太阳能一电能一化学能”转化,总反应为2CO2=2CO+O2.下列有关说法正确的是( )
我国预计在2020年前后建成自己的载人空间站.为了实现空间站的零排放,循环利用人体呼出的CO2并提供氧气.我国科学家设计了一种装置(如图所示),实现“太阳能一电能一化学能”转化,总反应为2CO2=2CO+O2.下列有关说法正确的是( )| A、该装置属于原电池 |
| B、X极反应式:O2+2H2O+4e-=4OH- |
| C、反应完毕,该太阳能装置中的电解质溶液碱性增强 |
| D、人体呼出的水蒸气参与Y极反应:CO2+H2O+2e-=CO+2OH- |
化学世界是个五彩缤纷的世界,下列关于颜色的变化叙述正确的是( )
| A、向盛有苯酚溶液的试管中滴入FeCl3溶液,溶液呈紫色 |
| B、淀粉溶液遇碘离子变蓝 |
| C、氨气能使湿润的蓝色石蕊试纸变红 |
| D、二氧化硫能使石蕊溶液变红后褪色 |

 硫元素有多种化合价,可形成多种化合物.
硫元素有多种化合价,可形成多种化合物. 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.