题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.4.2g乙烯和环丁烷的混合气中含有氢原子的数目为0.6NA
B.0.2 mol丁烯醛中含有双键的数目为0.2NA
C.常温常压下,22.4 L丙炔中含有分子的数目为NA
D.标准状况下,11.2 L甲醇中含有分子的数目为0.5NA
【答案】A
【解析】
A选项,乙烯和环丁烷的通式为CnH2n,4.2g乙烯和环丁烷的混合气中含有氢原子物质的量![]() ,氢原子的数目为0.6NA,故A正确;
,氢原子的数目为0.6NA,故A正确;
B选项,1 mol丁烯醛中含有双键有2 mol,1mol碳碳双键,1mol碳氧双键,因此0.2 mol丁烯醛中含有双键的数目为0.4NA,故B错误;
C选项,常温常压下气体摩尔体积大于22.4Lmol-1,22.4 L丙炔中含有分子的数目小于NA,故C错误;
D选项,标准状况下,甲醇是液态,无法计算分子的数目,故D错误;
综上所述,答案为A。

【题目】根据下列事实得出的结论正确的是( )。
选项 | 事实 | 结论 |
A | 甲、乙两种有机物具有相同的相对分子质量和不同的结构 | 甲和乙一定互为同分异构体 |
B | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 | 甲、乙两种分子中, |
C | 在淀粉溶液中加入稀硫酸,水浴加热一段时间后取出部分水解液,滴加银氨溶液后再加热,无银镜出现 | 淀粉的水解产物不具有还原性 |
D | 不存在两种邻二甲苯 | 苯分子中的碳碳键完全相同,苯不是单双键交替结构 |
A.AB.BC.CD.D
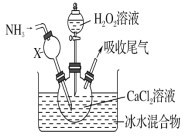
【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
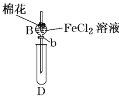
(1)棉花中浸润的溶液为____________,目的是____________________
(2)过程Ⅲ中一定发生反应的离子方程式为________________________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是______________________________________。
(3)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是___________________________。
(4)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |