题目内容
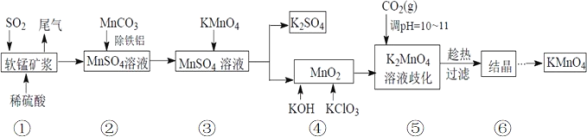
【题目】高锰酸钾是中学化学中常用的强氧化剂。某化学研究小组用软锰矿(主要成分为MnO2另含有少量铁、铝等金属的化合物)吸收燃煤尾气中的SO2,并制取MnO2和K2SO4,而后又用MnO2 制取KMnO4。设计生产流程如下:请回答下列问题:
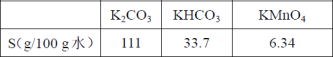
 20℃时,相关物质的溶解度数据见下表:
20℃时,相关物质的溶解度数据见下表:
(1)若将SO2气体通入下列溶液中,溶液不会褪色的是___。
A.紫色石蕊试液 B.品红溶液 C.新制氯水 D.酸性高锰酸钾溶液
(2)用 MnCO3 除去液体中的 Fe3+时发生的离子方程式__________。
(3)步骤④中应在______中熔化;
A.瓷坩埚 B.铁坩埚 C.石英坩埚 D.蒸发皿
当溶液调 pH达10~11时,停止通入 CO2。若 CO2过多,会造成的后果是:______。
(4)在此生产流程中,可循环使用的物质是(填名称)________。
步骤⑤中发生反应的化学方程式为_________;
步骤⑤之后,趁热过滤的理由是________。
【答案】A 3MnCO3+2Fe3++3H2O=3Mn2++2Fe(OH)3↓+3CO2↑ B CO2与K2CO3反应生成KHCO3,结晶时会同一起结晶析出,降低产品的纯度 MnO2、CO2、KMnO4 3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2↓ 防止KMnO4结晶析出,提高 KMnO4的产量
【解析】
(1)根据SO2的性质分析判断;
(2)MnCO3与溶液中的H+发生反应,使溶液中Fe3+形成Fe(OH)3沉淀而除去;
(3)KOH是碱,能够与SiO2在高温下反应,据此分析;
根据K2CO3与CO2及H2O反应转化为KHCO3分析;
(4)根据反应流程分析判断物质及反应的方程式。
(1)A.SO2与溶液中的水反应产生H2SO3,H2SO3是酸,具有酸的通性,可以使紫色石蕊试液变为红色,不褪色,A符合题意;
B.SO2具有漂白性,能够使品红溶液的红色褪去,B不符合题意;
C.新制氯水中含有HClO,HClO是具有强氧化性的物质,可以将有色物质氧化变为无色,因此具有漂白作用,C不符合题意;
D.酸性高锰酸钾溶液具有强的氧化性,SO2具有还原性,二者发生氧化还原反应而使溶液的紫色褪去,D不符合题意;
故合理选项是A;
(2)MnCO3与溶液中的H+发生反应,使溶液中c(OH-)增大,导致溶液中Fe3+形成Fe(OH)3沉淀而除去,则用MnCO3除去液体中的Fe3+时发生的离子方程式为:3MnCO3+2Fe3++3H2O=3Mn2++2Fe(OH)3↓+3CO2↑;
(3)KOH是碱,在高温下能够与SiO2反应,所以不能使用含有SiO2的容器反应;
A.瓷坩埚中含有SiO2,不能熔化KOH,A不符合题意;
B.铁坩埚中不含有SiO2,与Fe不能反应,可以熔化KOH,B符合题意;
C.石英坩埚主要成分是SiO2,与KOH在高温下反应,所以不能熔化KOH,C不符合题意;
D.蒸发皿主要成分是硅酸盐,其中含有SiO2,可以与KOH在高温下发生反应,不能在高温下熔融KOH,D不符合题意;
故合理选项是B;
向含有KOH的溶液中通入CO2气体,调整溶液的pH至10~11,二者反应产生K2CO3和水,若通入CO2过多,则又会发生反应:K2CO3+CO2+H2O=2KHCO3,结晶时会同KMnO4一起结晶析出,降低产品的纯度;
(4)向软锰矿(主要成分为MnO2)浆中加入稀硫酸,并通入SO2气体,发生氧化还原反应产生MnSO4,向该酸性溶液中加入MnCO3,消耗溶液中的H+,使溶液中的Fe3+、Al3+形成Fe(OH)3、Al(OH)3沉淀而除去,MnCO3与H+反应,产生Mn2+和CO2,向MnSO4溶液中加入KMnO4溶液,发生氧化还原反应产生MnO2,向其中再加入KOH、KClO3,发生氧化还原反应,产生K2MnO4,向该碱性溶液中通入CO2,调整溶液的pH至10~11,KOH与CO2反应产生K2CO3,K2MnO4发生歧化反应产生KMnO4、MnO2,CO2转化为MnCO3,所以在该流程中,能够循环利用的物质有MnO2、CO2、KMnO4;
步骤⑤中K2MnO4在CO2存在条件下,发生歧化反应产生KMnO4、MnO2,发生反应的化学方程式为3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2↓;
步骤⑤之后,要趁热过滤,这是由于温度高,KMnO4的溶解度大,温度降低,KMnO4的溶解度降低,导致KMnO4的产量降低,高温过滤就可以防止KMnO4结晶析出,从而提高 KMnO4的产量。

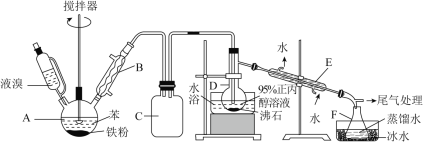
【题目】溴苯和1-溴丙烷是重要的医药中间体。某化学兴趣小组设计如下方案制得两种有机物,实验步骤如下:
I.连接装置后,检査气密性。向各容器中加入一定量的药品。
II.将液溴滴入装置A中,保持75℃水浴加热装置C10min。
III.反应完毕后,将装置F馏出液分离,得1-溴丙烷的粗产品。
IV.将分出的粗产品,依次用12mLH2O、12mL5%Na2CO3溶液和12mLH2O洗涤,进一步提纯得1-溴丙烷。
有关数据如下:
苯 | 溴 | 溴苯 | 1-溴丙烷 | 正丙醇 | |
密度/gcm-3 | 0.88 | 3.10 | 1.50 | 1.36 | 0.8 |
沸点/℃ | 80 | 59 | 156 | 71 | 97.1 |
水中溶解度 | 难溶 | 难溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
(1)写出装置A中发生反应的方程式:________。
(2)装置B的作用________。
(3)步骤IV中第一步水洗的目的主要是________。
(4)制得的溴苯中含有少量的苯,提纯溴苯的实验操作名称________。
(5)从锥形瓶内分离出1-溴丙烷粗产品,所采用的操作名称是________![]() 检验1-溴丙烷中的溴原子,需加入的试剂
检验1-溴丙烷中的溴原子,需加入的试剂![]() 按照先后顺序写
按照先后顺序写![]() ________。
________。