题目内容
【题目】铜及其化合物在工农业生产和日常生活中有着广泛的用途。请回答下列问题:
(1)基态铜原子的核外电子排布式为___。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2![]() NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有__![]() 填序号
填序号![]() 。
。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②F、N、O三种元素的第一电离能由大到小的顺序为__![]() 用元素符号表示
用元素符号表示![]()
(3)铜晶体铜原子的堆积方式为面心立方最密堆积。每个铜原子周围距离最近的铜原子数目为___。
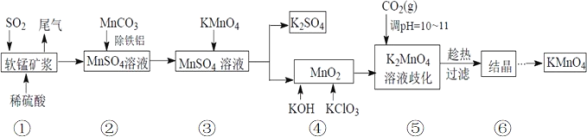
(4)某X原子的外围电子排布式为3s23p5,铜与X形成化合物的晶胞如图所示(黑点代表铜原子)。
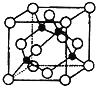
![]() 该晶体的化学式为___。
该晶体的化学式为___。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数的数值为NA,则该晶体中晶胞的棱长为__pm(只写计算式![]() 。
。
(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液![]() 醋酸二氨合铜(I)、氨水
醋酸二氨合铜(I)、氨水![]() 吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac(Ac表示醋酸根
吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac(Ac表示醋酸根![]()
①如果要提高上述反应的反应速率,可以采取的措施是___。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
②铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___。
③NH3的氮原子的杂化类型为___。
【答案】1s22s22p63s23p63d104s1 abd F>N>O 12 CuCl  ×1010 bc C>N>O>H sp3
×1010 bc C>N>O>H sp3
【解析】
![]() 是29号元素,原子核外电子数为29,基态原子核外电子排布式为:
是29号元素,原子核外电子数为29,基态原子核外电子排布式为:![]() ,
,
故答案为:![]() ;
;
![]() 氨气、氟气以及
氨气、氟气以及![]() 为分子晶体,铜为金属晶体,
为分子晶体,铜为金属晶体,![]() 为离子晶体,故答案为:abd;
为离子晶体,故答案为:abd;
![]() 同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,F、N、O中N原子最外层为半充满结构,较为稳定,所以它们的第一电离能大小顺序是
同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,F、N、O中N原子最外层为半充满结构,较为稳定,所以它们的第一电离能大小顺序是![]() ,故答案为:
,故答案为:![]() ;
;
![]() 在金属晶体的最密堆积中,对于每个原子来说,在其周围的原子有与之同一层上有六个原子和上一层的三个及下一层的三个,故每个原子周围都有12个原子与之相连,对于铜原子也是如此,故答案为:12;
在金属晶体的最密堆积中,对于每个原子来说,在其周围的原子有与之同一层上有六个原子和上一层的三个及下一层的三个,故每个原子周围都有12个原子与之相连,对于铜原子也是如此,故答案为:12;
![]() 价电子排布式为
价电子排布式为![]() ,则X原子为Cl原子;
,则X原子为Cl原子;
![]() 由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子属于顶点与面心上,晶胞中含有Cl原子数目为
由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子属于顶点与面心上,晶胞中含有Cl原子数目为![]() ,故化学式为CuCl,
,故化学式为CuCl,
故答案为:CuCl;
![]() 一个晶胞的摩尔质量为
一个晶胞的摩尔质量为![]() ,晶胞摩尔体积为
,晶胞摩尔体积为![]() ,则一个晶胞体积为
,则一个晶胞体积为![]() ,边长为
,边长为![]() ,
,
故答案为:![]() ;
;
![]() 增大浓度、升高温度等可增大反应速率,减压反应速率减小,减小生成物浓度,反应速率减小,故答案为:bc;
增大浓度、升高温度等可增大反应速率,减压反应速率减小,减小生成物浓度,反应速率减小,故答案为:bc;
![]() 铜液的组成元素中,短周期元素有H、C、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小,则原子半径
铜液的组成元素中,短周期元素有H、C、N、O等元素,H原子半径最小,同周期元素从左到右原子半径逐渐减小,则原子半径![]() ,故答案为:
,故答案为:![]() ;
;
![]() 氨气中价层电子对个数
氨气中价层电子对个数![]() 且含有1个孤电子对,所以N原子采用
且含有1个孤电子对,所以N原子采用![]() 杂化,故答案为:
杂化,故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】I.CO、CO2的应用和治理是当今社会的热点问题。
CO工业上可用于高炉炼铁,发生如下反应: 1/3Fe2O3(s) + CO(g)![]() 2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
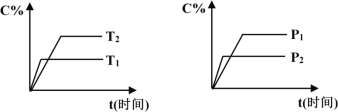
(1)该反应的正反应为_____反应(填“放热”或“吸热”),欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是____(选填序号)
a.及时吸收或移出CO2 b.增大反应体系的压强
c.用更高效的催化剂 d.粉碎矿石,增大接触面积
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时
FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时![]() 增大的是______(选填编号)。
增大的是______(选填编号)。
a.升高温度 b.增大压强
c.充入一定量CO d.再加入一些铁粉
II.合成尿素的反应为:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g)+Q(Q>0)。
CO(NH2)2(s)+H2O(g)+Q(Q>0)。
一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达到平衡,测得容器中CO2的浓度为0.05molL-1 。
完成下列填空:
(1)平均反应速率υ(NH3)=____________。
(2)下列描述中能说明上述反应已达平衡的是_________。(填序号)
a.2υ正(NH3)=υ逆(H2O) b.气体的平均相对分子质量不随时间而变化
c.NH3和CO2的比例保持不变 d.气体的压强不再发生变化
(3)为提高尿素的产率,工业上用该反应生产尿素时,合适的反应条件是_______。(填序号)
a.200℃ b.800℃ c.101 kPa d.24000 kPa