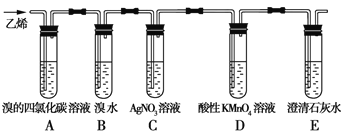
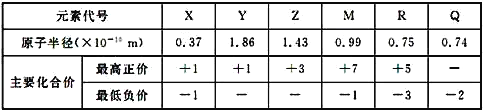
题目内容
【题目】下列用电子式表示化合物的形成过程,正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]()
【答案】B
【解析】
A.氯离子应该写在镁离子的两边;
B.K2S为离子化合物,离子化合物阴离子带电荷且用“[ ]”,共价化合物不带电荷,注意各原子或离子满足稳定结构;
C.氟化钙为离子化合物,钙离子与两个氟离子通过离子键结合,阴阳离子需要标出所带电荷;
D.H2O为共价化合物。
A.镁原子失去最外层的2个电子形成稳定的镁离子,2个氯原子从镁原子分别得到1个电子形成稳定的氯离子,在镁离子与氯离子的静电作用下结合形成氯化镁,用电子式表示下列物质的形成过程为:![]() ,A错误;
,A错误;
B.K2S为离子化合物,用电子式表示形成过程为![]() ,B正确;
,B正确;
C.氟化钙为离子化合物,阴阳离子需要标出所带电荷,用电子式表示其形成过程为:![]() ,C错误;
,C错误;
D.H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为![]() ,D错误;
,D错误;
故合理选项是B。

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量